题目内容
“纸质电池”于2006年被美国《时代》周刊评为年度8大最佳创新技术之一.这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰.电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH)关于此电池,下列说法正确的是( )
分析:根据电池反应式知,锌易失电子发生氧化反应而作负极,电极反应式为Zn-2e-+2OH-=ZnO+H2O,MnO2被还原,应为原电池的正极,电极反应式为MnO2+e-+H2O=MnO(OH)+OH-,电子从负极沿导线流向正极,电解质溶液中阴离子向负极移动,阳离子向正极移动,根据锌和转移电子之间的关系式进行计算.
解答:解:A.该原电池中锌作负极,二氧化锰作正极,电子从负极锌沿导线流向正极二氧化锰,故A错误;
B.该原电池中,二氧化锰得电子而作正极,电极反应式为MnO2+e-+H2O=MnO(OH)+OH-,故B正确;
C.该原电池中,每转移0.1mol电子,消耗锌的质量=
×65g/mol=3.25g,故C错误;
D.原电池放电时,电解质溶液中氢氧根离子向负极锌移动,故D错误;
故选B.
B.该原电池中,二氧化锰得电子而作正极,电极反应式为MnO2+e-+H2O=MnO(OH)+OH-,故B正确;
C.该原电池中,每转移0.1mol电子,消耗锌的质量=
| 0.1mol |
| 2 |
D.原电池放电时,电解质溶液中氢氧根离子向负极锌移动,故D错误;
故选B.
点评:本题考查了原电池原理,根据元素化合价变化来确定正负极及电极反应式,再结合离子移动方向、电子移动方向来分析解答,难度中等,难点的离子移动方向的判断.

练习册系列答案
相关题目
“纸质电池”于2006年被美国《时代》周刊评为年度8大最佳创新技术之一。这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应为: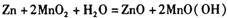 关于此电池,下列说法正确的是
关于此电池,下列说法正确的是
| A.电子从MnO2通过外电路流向 |
B.该电池的正极反应为: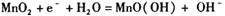 |
| C.每转移0.1mol电子,消耗了 6.5g Zn |
| D.电池工作时OH-能通过薄层纸片向附着二氧化锰的电极移动 |
 关于此电池,下列说法正确的是
关于此电池,下列说法正确的是