题目内容
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法正确的是
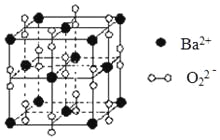
A.与每个Ba2+距离相等且最近的Ba2+共有6个
B.晶体中Ba2+的配位数为8
C.晶体的化学式为Ba2O2
D.该氧化物是含有非极性键的离子化合物
【答案】D
【解析】
晶胞中Ba2+离子位于晶胞的顶点和面心位置,晶胞中共含有Ba2+离子的个数为8×![]() +6×
+6×![]() =4,阴离子位于晶胞的边上和体心位置,共含有阴离子的个数为12×
=4,阴离子位于晶胞的边上和体心位置,共含有阴离子的个数为12×![]() +1=4,所以晶胞中Ba2+与阴离子的个数比为1:1,该氧化物为BaO2。
+1=4,所以晶胞中Ba2+与阴离子的个数比为1:1,该氧化物为BaO2。
A.与每个Ba2+距离相等且最近的Ba2+为顶点和面心位置,每个晶胞中含有3×![]() 个,每个顶点为8个晶胞共有,则共有8×3×
个,每个顶点为8个晶胞共有,则共有8×3×![]() =12个,故A错误;
=12个,故A错误;
B.晶体中位于顶点的Ba2+离子和位于边上的阴离子距离最近,每个顶点为8个晶胞所共有,而每个边为4个晶胞共有,每个晶胞中有3个边上的阴离子距离相等且最近,根据均摊法计算,晶体中每个Ba2+同时吸引着阴离子的数目为8×3×![]() =6,故B错误;
=6,故B错误;
C.由以上分析可知晶体的化学式为BaO2,故C错误;
D.该物质为活泼金属和活泼非金属形成的化合物,应为离子化合物,含有O-O,为非极性键,为含有非极性键的离子化合物,故D正确;
故选D。

【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+3/2O2(g) △H= a kJ mol-1。
2NH3(g)+3/2O2(g) △H= a kJ mol-1。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
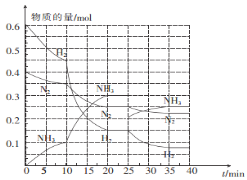
①0~10 min内,以NH3表示的平均反应速率为_________。
②在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 20 min达到第一次平衡,在反应进行至25 min时,曲线发生变化的原因是____________,35min达到第二次平衡,则平衡的平衡常数K1______K2(填“>”“<”或“ = ”)
【题目】第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。继续失去第二个电子所需能量称第二电离能。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。回答下列问题:
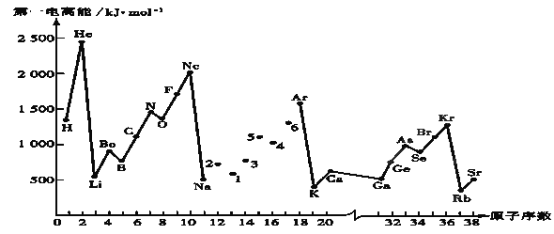
(1)同一周期元素的第一电离能从左到右总趋势是___(填增大、减小或不变,下同);同一主族元素原子从上到下的第一电离能I1变化规律是______________;稀有气体的第一电离能在同周期中是最大的,原因是______________________________________________________________________。
(2)认真分析上图中同周期元素第一电离能的变化规律,发现有一些反常,第一电离能 IIA>IIIA,VA>VIA: 如I1(铍)>I1(硼),2号大于1号,I1(氮)>I1(氧),5号大于4号。可能原因是____。(3)已知2号的I1=738KJ/mol, 则它的I2___738KJ/mol, I3___3×738KJ/mol;(填>、<、=)(4)已知5号和6号元素的电负性分别为2.1和3.0,则4号元素的电负性可能为(___)
A.3.5 | B.1.8 | C.2.5 | D.4.0 |
(5)上图中4、5、6三种元素最高价含氧酸的酸性从强到弱顺序为____________(用对应酸的化学式表示);它们的气态氢化物的稳定性均比同主族上一周期的元素气态氢化物弱,原因是:_________。
【题目】请用序号填空:
①13C与14C ②正丁烷与异丁烷
③CH3CH3与CH3CH2CH3 ④
(1)属于同位素的是______;
(2)属于同系物的是______;
(3)属于同分异构体的是______。
【题目】将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。
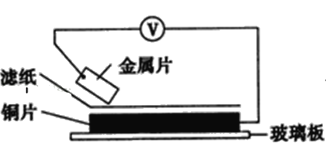
在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大)依据记录数据判断,下列结论中正确的是( )
金属 | 电子流动方向 | 电压(V) |
甲 | 甲→Cu | +0.78 |
乙 | Cu→乙 | -0.15 |
丙 | 丙→Cu | +1.35 |
丁 | 丁→Cu | +0.30 |
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
C.在四种金属中乙的还原性最强
D.甲、丁若形成原电池时,甲为正极