题目内容
将密度为1.84 g / cm3、质量分数为98%的浓硫酸稀释成1 000 mL、物质的量浓度为2 mol /L、密度为1.20 g / cm3的稀硫酸。求:
(1)所需浓硫酸的体积;
(2)所需水的体积。
(1)108.7 mL (2)1000 mL
【解析】
试题分析:解:n(硫酸)=2 mol /L×1 L=2 mol
m(硫酸)=2 mol×98 g / mol=196 g
m(浓硫酸)=196 g÷98%=200 g
V(浓硫酸)=200 g÷1.84 g / cm3 =108.7 mL
m(稀硫酸)=1.20 g / cm3×1 000 mL=1 200 g
m(水)=1 200 g-200 g=1 000 g
V(水)=1 000 g÷1.00 g / cm3=1 000 mL
考点:物质的量以及物质的量浓度的相关计算
点评:该题是基础性试题的考查,但是该题给出的条件较多,信息量太多,这需要学生熟悉掌握相关的知识才能够较快解答此题。

 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案(14分)I.实验室用Na2CO3·10H2O晶体配制50 g质量分数为21.2%的Na2CO3溶液。回答下列问题:
(1)应用托盘天平称取Na2CO3·10H2O晶体 g。
(2)用托盘天平和小烧杯称出碳酸钠晶体的质量,天平平衡后的状态如下图。由图中可以看出,该同学在操作时犯了一个错误是 。实际称量的碳酸钠晶体质量为 g。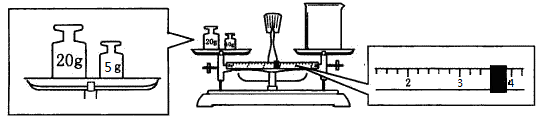
II. 实验室要配制2.5 mol/L 的稀硫酸溶液90 mL,回答下列问题:
(1)用量筒量取质量分数为98%,密度为1.84 g/cm3的浓硫酸 mL。
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是 。
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是 。
| A.量取浓硫酸时,仰视读数 |
| B.洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中 |
| C.稀释硫酸时,有溶液溅到桌面上 |
| D.没有洗涤稀释硫酸的烧杯和玻璃棒 |
F.容量瓶不干燥
(4)从容量瓶中取该溶液40 mL,与5 mol/L的NaOH溶液 mL恰好完全反应,反应后溶液中的c(Na+)= (忽略溶液混合过程中的体积变化)
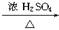 C2H5Br+H2O
C2H5Br+H2O