题目内容
(1)浓度均为0.1mol/L的8种溶液:①HNO3 ②H2SO4 ③CH3COOH ④Ba(OH)2 ⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl,溶液pH值由小到大的顺序是:(填写编号)
(2)氯化铝水溶液呈
(3)在①pH=3的硫酸溶液和②pH=3的醋酸溶液中,分别投入足量锌粉,开始时反应速率大小为①
②①③⑧⑦⑥⑤④
②①③⑧⑦⑥⑤④
.(2)氯化铝水溶液呈
酸
酸
性,原因是(用离子方程式表示):Al3++3H2O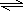 Al(OH)3+3H+
Al(OH)3+3H+
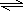 Al(OH)3+3H+
Al(OH)3+3H+Al3++3H2O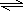 Al(OH)3+3H+
Al(OH)3+3H+
.把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是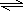 Al(OH)3+3H+
Al(OH)3+3H+Al2O3
Al2O3
.(3)在①pH=3的硫酸溶液和②pH=3的醋酸溶液中,分别投入足量锌粉,开始时反应速率大小为①
=
=
②(请填=、>、<,下同);反应结束后,生成的H2的体积(同温同压)①<
<
②;当加水稀释相同的倍数,pH值①>
>
②.分析:(1)先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较PH;
(2)氯化铝为强酸弱碱盐,根据Al3+的水解特点分析;
(3)从醋酸为弱酸的角度分析.
(2)氯化铝为强酸弱碱盐,根据Al3+的水解特点分析;
(3)从醋酸为弱酸的角度分析.
解答:解:(1)溶液呈碱性的有:④⑤⑥,其中④为二元强碱,①为一元强碱,⑥水解呈碱性,浓度相同时,PH:④>⑤>⑥;
溶液呈中性的有:⑦;
溶液呈酸性的有:①②③⑧,其中①为一元强酸,②为二元强酸,③为弱酸,⑧水解呈酸性,浓度相同时,
PH:②<①<③<⑧,
故答案为:②①③⑧⑦⑥⑤④;
(2)氯化铝为强酸弱碱盐,Al3+的水解:Al3++3H2O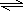 Al(OH)3+3H+,溶液呈酸性,
Al(OH)3+3H+,溶液呈酸性,
氯化铝的水解为吸热过程,加热促进水解,把AlCl3溶液蒸干,得到Al(OH)3,灼烧,分解生成Al2O3,最后得到的主要固体产物是Al2O3,
故答案为:酸;Al3++3H2O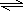 Al(OH)3+3H+;Al2O3;
Al(OH)3+3H+;Al2O3;
(3)醋酸为弱酸,pH=3的硫酸溶液和pH=3的醋酸溶液相比较,醋酸浓度大,分别投入足量锌粉,开始时醋酸溶液反应速率大,因醋酸物质的量多,则完全反应生成氢气多,加水稀释时,醋酸进一步电离,则当加水稀释相同的倍数,硫酸PH变化范围大,
故答案为:=;<;>.
溶液呈中性的有:⑦;
溶液呈酸性的有:①②③⑧,其中①为一元强酸,②为二元强酸,③为弱酸,⑧水解呈酸性,浓度相同时,
PH:②<①<③<⑧,
故答案为:②①③⑧⑦⑥⑤④;
(2)氯化铝为强酸弱碱盐,Al3+的水解:Al3++3H2O
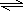 Al(OH)3+3H+,溶液呈酸性,
Al(OH)3+3H+,溶液呈酸性,氯化铝的水解为吸热过程,加热促进水解,把AlCl3溶液蒸干,得到Al(OH)3,灼烧,分解生成Al2O3,最后得到的主要固体产物是Al2O3,
故答案为:酸;Al3++3H2O
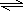 Al(OH)3+3H+;Al2O3;
Al(OH)3+3H+;Al2O3;(3)醋酸为弱酸,pH=3的硫酸溶液和pH=3的醋酸溶液相比较,醋酸浓度大,分别投入足量锌粉,开始时醋酸溶液反应速率大,因醋酸物质的量多,则完全反应生成氢气多,加水稀释时,醋酸进一步电离,则当加水稀释相同的倍数,硫酸PH变化范围大,
故答案为:=;<;>.
点评:本题考查盐类水解及弱电解质的电离,题目难度中等,注意盐类的水解、弱电解质的电离特点.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目