题目内容
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表的第______族,其基态原子中未成对电子个数为________。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________________________________,所含非金属元素的电负性由大到小的顺序是_____________________________。
(3)尿素[CO(NH2)2]分子中,碳原子为_______杂化,分子中σ键与π键的数目之比为_________。
(4)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为__________。

(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为____________。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子的距离为__________pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
【答案】VIII 3 [Ar]3d5或1s22s22p63s23p63d5 O>N>C>H sp2 7:1 SO42-、NH3 FeC ![]() ×1010pm
×1010pm
【解析】
(1)根据钴在元素周期表中位置确定;
(2)根据铁在元素周期表中位置确定Fe3+的核外电子排布式;根据非金属性强弱确定电负性大小;
(3)根据尿素[CO(NH2)2]分子的结构式![]() 确定碳原子的杂化方式,分子中σ键与π键的数目之比;
确定碳原子的杂化方式,分子中σ键与π键的数目之比;
(4)溴离子为配合物的外界,在水溶液中以离子形式存在,若加入AgNO3溶液时,会产生淡黄色沉淀溴化银;
(5)根据晶胞中每个顶点1/8原子,每条棱上1/4个原子,每个面1/2个原子,体心1个原子计算出Fe,C原子个数比,找到化学式;根据图像可知晶胞中最近的两个碳原子的距离为面对角线的一半,根据密度计算出棱长,再利用勾股定理计算。
(1)钴的原子序数27,位于元素周期表的第四周期第VIII族,其基态原子排布式为1s22s22p63s23p63d74s2,所以未成对电子个数为3;
正确答案:VIII 3 。
(2)铁的原子序数26, Fe3+的核外电子排布式为1s22s22p63s23p63d5,[Fe(H2NCONH2)]6(NO3)3所含非金属元素为C、H、O、N,根据非金属性越强,电负性越大,可得电负性由大到小的顺序是O>N>C>H;
正确答案:O>N>C>H。
(3)根据尿素[CO(NH2)2]分子的结构式![]() ,C原子上没有孤对电子,形成3个σ键,1个π键,所以1个所以尿素分子中碳原子的杂化方式为sp2杂化,分子中σ键为3个C-C和4个C-H共7个与π键的数目之比为7:1;
,C原子上没有孤对电子,形成3个σ键,1个π键,所以1个所以尿素分子中碳原子的杂化方式为sp2杂化,分子中σ键为3个C-C和4个C-H共7个与π键的数目之比为7:1;
正确答案:sp2 7:1。
(4)溴离子为配合物的外界,在水溶液中以离子形式存在,若加入AgNO3溶液时,会产生淡黄色沉淀溴化银,所以第二种配合物的配体为SO42-、NH3;
正确答案:SO42-、NH3。
(5)晶胞中Fe原子数:8×![]() +6×
+6×![]() =4,晶胞中C原子数:12×
=4,晶胞中C原子数:12×![]() +1=4,所以铁碳原子数之比为1:1,化学式为FeC;设晶胞棱长为x,根据晶体密度列等式d g·cm-3=m/V=
+1=4,所以铁碳原子数之比为1:1,化学式为FeC;设晶胞棱长为x,根据晶体密度列等式d g·cm-3=m/V=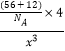 得出x=
得出x=![]() cm=
cm=![]() ×1010pm,根据勾股定理两个碳原子最近距离为
×1010pm,根据勾股定理两个碳原子最近距离为![]() ×1010pm。
×1010pm。
正确答案:![]() ×1010pm。
×1010pm。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案