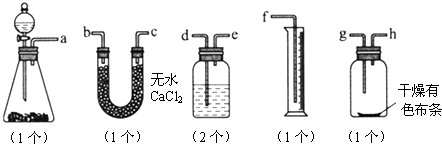
题目内容
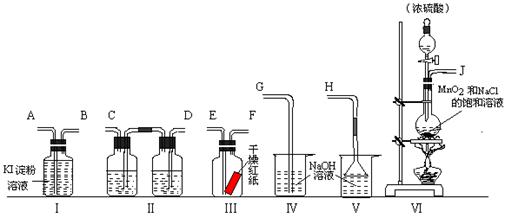
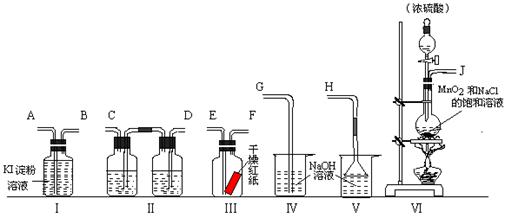
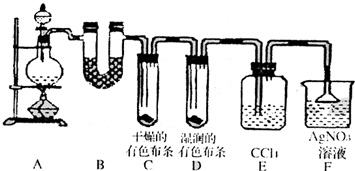
为了证明干燥氯气无漂白性以及卤素氧化性的强弱,可先制取氯气再进行性质实验.如图为实验所提供的仪器和药品,据此回答下列问题: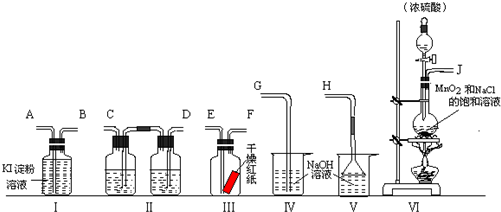
(1)各仪器装置连接的顺序为(填接口序号)
(2)装置Ⅰ中的现象是
(3)仪器Ⅱ中分别加入的试剂为
分析:(1)根据实验目的先制取干燥的氯气,然后检验干燥氯气的漂白性;再利用卤素单质之间的氧化性关系设计实验检验卤素氧化性的强弱;
(2)根据氯气氧化性强于碘单质,淀粉遇碘变蓝判断现象;写出氯气与碘离子反应的离子方程式;
(3)装置Ⅱ分别用于吸收氯气中的氯化氢和干燥氯气,据此选择合适的试剂.
(2)根据氯气氧化性强于碘单质,淀粉遇碘变蓝判断现象;写出氯气与碘离子反应的离子方程式;
(3)装置Ⅱ分别用于吸收氯气中的氯化氢和干燥氯气,据此选择合适的试剂.
解答:解:(1)证明干燥氯气无漂白性以及卤素氧化性的强弱,可先制取氯气再进行性质实验,氯气氯气使用装置Ⅵ,然后使用装置Ⅱ除去氯气中的装置氯化氢、干燥氯气,将干燥的氯气通入装置Ⅲ检验干燥氯气是否具有漂白性,再将氯气通入装置Ⅰ检验氯气的氧化性与碘单质氧化性强弱,最后使用使用装置Ⅳ吸收多余的氯气,所以各仪器装置连接的顺序为:J接 D、C 接E、F接A、B接G,
故答案为:J;D;C;E;F;A;B;G;
(2)氯气通入碘化钠溶液中,碘离子被氯气氧化成碘单质,溶液变成蓝色,反应的离子方程式为:Cl2+2I-=I2+2Cl-,
故答案为:溶液变为蓝色;Cl2+2I-=I2+2Cl-;
(3)仪器Ⅱ中的作用是除去氯气中的氯化氢和干燥氯气,使用饱和食盐水除去杂质氯化氢,使用浓硫酸干燥氯气,所以盛放的试剂为饱和食盐水和浓硫酸,
故答案为:饱和食盐水;浓硫酸.
故答案为:J;D;C;E;F;A;B;G;
(2)氯气通入碘化钠溶液中,碘离子被氯气氧化成碘单质,溶液变成蓝色,反应的离子方程式为:Cl2+2I-=I2+2Cl-,
故答案为:溶液变为蓝色;Cl2+2I-=I2+2Cl-;
(3)仪器Ⅱ中的作用是除去氯气中的氯化氢和干燥氯气,使用饱和食盐水除去杂质氯化氢,使用浓硫酸干燥氯气,所以盛放的试剂为饱和食盐水和浓硫酸,
故答案为:饱和食盐水;浓硫酸.
点评:本题考查了氯、溴、碘的性质实验,主要考查了实验装置的选择及试剂的选择,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.

练习册系列答案
相关题目
 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.