题目内容
(08上海重点中学第二次联考)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。工业上常通过下列反应制备CuCl:
2CuSO4 + Na2SO3 + 2NaCl + Na2CO3 → 2 CuCl ↓ + 3Na2SO4 + CO2 ↑
(1) CuCl制备过程中需要配置质量分数为20.0%的CuSO4溶液,该溶液所需的
CuSO4 ? 5H2O与H2O的质量之比为_____________________ 。
准确称取0.2500gCuCl样品置于一定量的0.5mol/L FeCl3 溶液中,待样品完全溶解后, 加水20 ml ,用0.1000mol/L的Ce (SO4)2溶液滴定到终点,消耗24.60 ml Ce (SO4)2溶液。有关化学反应为:Fe3+ + CuCl → Fe2+ + Cu2+ + Cl- 、 Ce4+ + Fe2+ → Fe3+ + Ce3+ 。通过计算说明上述样品中的质量分数是否符合标准。
答案:
(1)5:11 2’
(2)符合标准(97.91%>96.50%) 2’

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
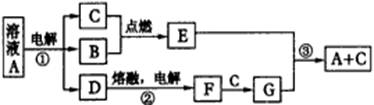
活力试卷系列答案(08上海重点中学第二次联考)A、B、C、D、E、F、G是由短周期元素组成的七种物质,其中B、C、F是单质;常温下B、C、E为气体;A物质的焰色反应呈黄色。(下图中反应②的部分产物未表示出来。)
|
各物质间的转化关系 |
根据上图所示转化关系回答:
(1)经测定G属于离子化合物,其电子式为___________。
(2)写反应②的电极反应式:
阳极___________ ; 阴极___ 。
(3)反应③的化学方程式为___ 。
(4)这七种物质中含有共价键的有___________ (用化学式回答)。