题目内容
8.下列四种物质,熔点由低到高的是( )| A. | 金刚石、食盐、干冰、水 | B. | 食盐、金刚石、水、干冰 | ||
| C. | 水、干冰、食盐、金刚石 | D. | 干冰、水、食盐、金刚石 |
分析 一般情况下,不同类型的晶体,熔点:原子晶体>离子晶体>分子晶体;同种类型的晶体可根据影响晶体的因素分析.
解答 解:金刚石为原子晶体,食盐为离子晶体,干冰、水为分子晶体,水分子间存在氢键,水的熔点大于干冰,则熔点由低到高的是:干冰、水、食盐、金刚石,故D正确;
故选D.
点评 本题考查晶体的熔沸点高低的比较,题目难度不大,比较晶体熔沸点高低要从晶体熔沸点影响因素考虑.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列关于卤族元素由上到下性质递变的叙述,正确的是( )
(1)单质的氧化性增强 (2)单质的颜色加深
(3)气态氢化物的稳定性增强 (4)单质的沸点升高
(5)阴离子的还原性增强.
(1)单质的氧化性增强 (2)单质的颜色加深
(3)气态氢化物的稳定性增强 (4)单质的沸点升高
(5)阴离子的还原性增强.
| A. | (1)(2 ) (3) | B. | (2)(3)(4) | C. | (2)(4)(5) | D. | (1)(3)(5) |
16.以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂.从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用.废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为V2O5+2H+=2VO2++H2O,同时V2O4转化成VO2+.“废渣1”的主要成分是SiO2.
(2)“氧化”中欲使3mol的VO2+变为VO2+,则需要氧化剂KClO3至少为0.5mol.
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为V2O5+2H+=2VO2++H2O,同时V2O4转化成VO2+.“废渣1”的主要成分是SiO2.
(2)“氧化”中欲使3mol的VO2+变为VO2+,则需要氧化剂KClO3至少为0.5mol.
13.在新制的氯水中存在平衡:Cl2+H2O?HCl+HClO.加入少量下列物质能使c(HClO)增大的是( )
| A. | H2S | B. | NaOH | C. | CaCO3 | D. | HCl |
20.下列说法不正确的是( )
| A. | 燃烧煤炭供热会加剧“温室效应“ | |
| B. | 将废旧电池深埋处理,可有效防止电池中的重金属污染 | |
| C. | 预防H7N9流感病毒的措施之一是高温消毒餐具等生活日用品 | |
| D. | 开发利用太阳能、风能、生物能、海洋能等清洁能源,符合“低碳经济” |
17.下列关于实验原理或操作的叙述中,正确的是( )
①从碘水中提取单质碘时,可用无水乙醇代替CCl4
②可以用NaOH溶液除去溴苯中的溴杂质
③不能用酸性KMnO4溶液可以除去乙烯中混有的乙炔
④配制银氨溶液:往稀氨水中加硝酸银产生白色沉淀,再滴加过量的硝酸银至白色沉淀正好溶解.
①从碘水中提取单质碘时,可用无水乙醇代替CCl4
②可以用NaOH溶液除去溴苯中的溴杂质
③不能用酸性KMnO4溶液可以除去乙烯中混有的乙炔
④配制银氨溶液:往稀氨水中加硝酸银产生白色沉淀,再滴加过量的硝酸银至白色沉淀正好溶解.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
18.根据阿伏加德罗定律判断,下列叙述不正确的是( )
| A. | 同温同压下,a g甲气体和2a g乙气体所占体积之比为1:2,同温同压下甲和乙的密度之比为1:2 | |
| B. | 同温同体积下等质量的CO和N2的压强之比为1:1 | |
| C. | 某温度T下,压强为2个大气压时,一定量 C2H4 的体积和其在标况下的体积相等,则T=546K | |
| D. | 同温同压下等质量的H218O和D216O所含原子数相等 |
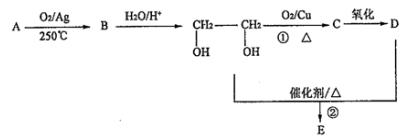
 .
.