题目内容
下列化学用语表达正确的是( )A.HClO的电子式
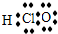
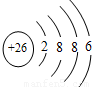
B.Fe2+的离子结构示意图:
C.光气COCl2的结构式:

D.sp2杂化轨道模型:

【答案】分析:A、氯原子最外层电子数为7,形成1对共用电子对,氧原子最外层电子数为6,形成2对共用电子对.
B、Fe原子失去4s能级的2个电子形成Fe2+,Fe2+离子质子数为26,核外电子数为24,有3个电子层,最外层电子数为14.
C、光气COCl2分子中碳原子与氧原子之间形成2对共用电子对,碳原子与氯原子之间形成1对共用电子对,碳原子连接2个氯原子.
D、sp2杂化轨道由1个ns轨道和2个np轨道组合而形成的,每个杂化轨道含有三分之一的s轨道成分和三分之二p轨道成分,杂化轨道间夹角为120°,呈平面三角形.
解答:解:A、氯原子最外层电子数为7,形成1对共用电子对,氧原子最外层电子数为6,形成2对共用电子对,次氯酸分子中氧原子分别通过1对共用电子对与氯原子、氢原子结合,次氯酸结构式为H-O-Cl,故A错误;
B、Fe原子失去4s能级的2个电子形成Fe2+,Fe2+离子质子数为26,核外电子数为24,有3个电子层,最外层电子数为14,Fe2+离子结构示意图为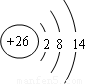 ,故B错误;
,故B错误;
C、光气COCl2分子中碳原子与氧原子之间形成2对共用电子对,碳原子连接2个氯原子,碳原子与氯原子之间形成1对共用电子对,COCl2的结构式为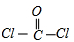 ,故C错误;
,故C错误;
氯离子质子数为17,核外电子数为18,有3个电子层,最外层电子数为8,氯离子结构示意图为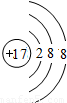 ,C错误;
,C错误;
D、sp2杂化轨道由1个ns轨道和2个np轨道组合而形成的,每个杂化轨道含有三分之一的s轨道成分和三分之二p轨道成分,杂化轨道间夹角为120°,呈平面三角形,sp2杂化轨道模型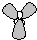 ,故D正确.
,故D正确.
故选:D.
点评:考查常用化学用语,难度中等,注意亚铁离子的结构示意图为易错点,容易按能级顺序失去电子,由基态到激发态按能层失去电子.
B、Fe原子失去4s能级的2个电子形成Fe2+,Fe2+离子质子数为26,核外电子数为24,有3个电子层,最外层电子数为14.
C、光气COCl2分子中碳原子与氧原子之间形成2对共用电子对,碳原子与氯原子之间形成1对共用电子对,碳原子连接2个氯原子.
D、sp2杂化轨道由1个ns轨道和2个np轨道组合而形成的,每个杂化轨道含有三分之一的s轨道成分和三分之二p轨道成分,杂化轨道间夹角为120°,呈平面三角形.
解答:解:A、氯原子最外层电子数为7,形成1对共用电子对,氧原子最外层电子数为6,形成2对共用电子对,次氯酸分子中氧原子分别通过1对共用电子对与氯原子、氢原子结合,次氯酸结构式为H-O-Cl,故A错误;
B、Fe原子失去4s能级的2个电子形成Fe2+,Fe2+离子质子数为26,核外电子数为24,有3个电子层,最外层电子数为14,Fe2+离子结构示意图为
 ,故B错误;
,故B错误;C、光气COCl2分子中碳原子与氧原子之间形成2对共用电子对,碳原子连接2个氯原子,碳原子与氯原子之间形成1对共用电子对,COCl2的结构式为
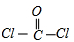 ,故C错误;
,故C错误;氯离子质子数为17,核外电子数为18,有3个电子层,最外层电子数为8,氯离子结构示意图为
 ,C错误;
,C错误;D、sp2杂化轨道由1个ns轨道和2个np轨道组合而形成的,每个杂化轨道含有三分之一的s轨道成分和三分之二p轨道成分,杂化轨道间夹角为120°,呈平面三角形,sp2杂化轨道模型
 ,故D正确.
,故D正确.故选:D.
点评:考查常用化学用语,难度中等,注意亚铁离子的结构示意图为易错点,容易按能级顺序失去电子,由基态到激发态按能层失去电子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化学用语表达正确的是( )
A、对-硝基甲苯的结构简式: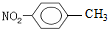 | B、NH4Cl的电子式为: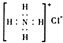 | C、H216O与D216O互为同素异形体 | D、乙炔的最简式:CH |
下列化学用语表达正确的是( )
A、S2-的结构示意图: | B、NH3的结构式: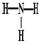 | C、氯化钠的电子式: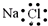 | D、乙烯的结构简式:CH2CH2 |


