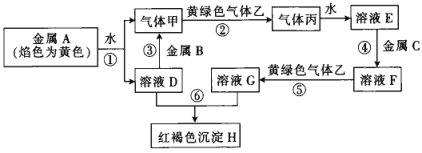
题目内容
【题目】常温下,在体积均为20mL、浓度均为0.1mol/L的HX溶液、HY溶液中分别滴加0.1mol/L的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加NaOH溶液体积的关系如图所示。下列推断正确的是
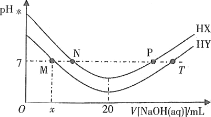
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都一定降低
D.常温下,HY的电离常数![]()
【答案】D
【解析】
A.依题意,HX和HY是两种一元酸,由图像可知,加入NaOH溶液,水电离程度增大,溶液由酸性逐渐变为中性,当恰好完全反应时溶液呈碱性且水的电离程度最大,HX为弱酸,A错误;
B.T点时溶液为NaY和NaOH的混合溶液,溶液显碱性,故c(H+) ≠ c(OH-),B错误;
C.N点时溶液为HX和NaX的混合溶液,溶液呈中性,加水稀释溶液的pH不变;P点时溶液为NaX和NaOH的混合溶液,溶液呈碱性,加水稀释碱性减弱,溶液pH降低,C错误;
D.取M点计算电离平衡常数c(H+)=c(OH-)=1![]() 10-7mol/L,混合溶液中c(Na+)=c(Y-)=
10-7mol/L,混合溶液中c(Na+)=c(Y-)=![]()
![]() 0.1mol/L,c(HY)=
0.1mol/L,c(HY)=![]()
![]() 0.1mol/L,Ka=
0.1mol/L,Ka=![]() ,D正确;
,D正确;
故选D。

练习册系列答案
相关题目
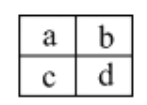
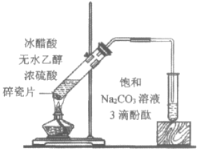
【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸