��Ŀ����
��11�֣���ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�ء���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ��mol-1��-283.0kJ��mol-1��-726.5kJ��mol-1����ش��������⣺
��1����̫���ֽܷ�10molˮ���ĵ�������_____________kJ��
��2���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ_____________��
��3�����ݻ�Ϊ2L���ܱ������У���CO2��H2�ϳɼ״����������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ��ע��T1��T2������300�棩��
����˵����ȷ����______������ţ�
���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���ƽ������Ϊ
v(CH3OH)=nA/tA mol��L-1��min-1
�ڸ÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ��С
�۸÷�ӦΪ���ȷ�Ӧ
�ܴ���A��ķ�Ӧ��ϵ��T1�䵽T2��
�ﵽƽ��ʱ����
��4����T1�¶�ʱ����1molCO2��3molH2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2ת����Ϊa,�������ڵ�ѹǿ����ʼѹǿ֮��Ϊ______��
��5����ֱ���Լ״�Ϊȼ�ϵ���У��������ҺΪ���ԣ������ķ�ӦʽΪ________�������ķ�ӦʽΪ________������״̬�£���ȼ�ϵ������1mol�״����ܲ�����������Ϊ702.1KJ,���ȼ�ϵ�ص�����Ч��Ϊ________��ȼ�ϵ�ص�����Ч����ָ�������������������ȼ�ϵ�ط�Ӧ�����ͷŵ�ȫ������֮�ȣ�
��11�֣�(1) 2858
(2) CH3OH(l)+O2(g)=CO(g)+2 H2O(l) ��H=-443.5kJ��mol-1
(3) �ۢ� (4)1-a/2
(5) CH3OH(g) +H2O-6e-=CO2 +6H+ 3/2O2 + +6H+ +6e-=3H2O
96.6%
����:��

 ��2011?��������ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1����ش��������⣺
��2011?��������ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1����ش��������⣺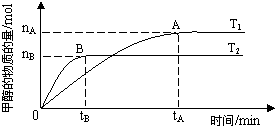 ��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1�� ̼�ǻ�������������Ԫ�أ��䵥�ʼ������������������������Ҫ��Դ���ʣ�
̼�ǻ�������������Ԫ�أ��䵥�ʼ������������������������Ҫ��Դ���ʣ�