题目内容
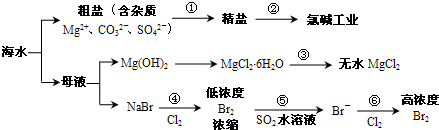
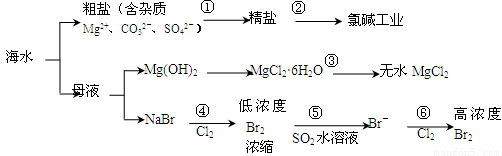
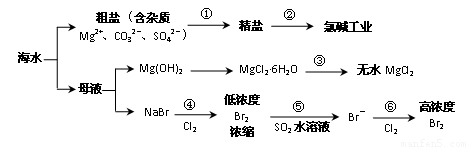
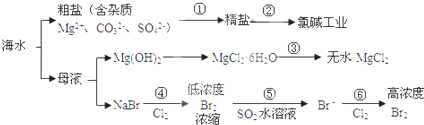
根据下图海水综合利用的工业流程图,判断下列说法正确的是
已知:MgCl2?6H2O受热生成Mg(OH)Cl和HCl气体等.( )

已知:MgCl2?6H2O受热生成Mg(OH)Cl和HCl气体等.( )
| A、氯碱工业中电解饱和食盐水是一个将化学能转化为电能的过程 | B、在过程③中将MgCl2?6H2O灼烧即可制得无水MgCl2 | C、在过程④、⑥反应中每氧化0.2 mol Br- 需消耗0.1mol Cl2 | D、过程⑤在生产中无需解决其对金属设备的腐蚀问题 |
分析:A、根据电解饱和食盐水的电解装置中能量转化知识进行判断;
B、氯化镁中镁离子会水解,生成氢氧化镁以及氯化氢,据氯化氢的挥发性进行分析;
C、根据化学反应计算消耗氯气的物质的量;
D、根据反应⑤二氧化硫与溴单质的生成产物进行分析.
B、氯化镁中镁离子会水解,生成氢氧化镁以及氯化氢,据氯化氢的挥发性进行分析;
C、根据化学反应计算消耗氯气的物质的量;
D、根据反应⑤二氧化硫与溴单质的生成产物进行分析.
解答:解:A、电解饱和食盐水的电解装置中,是将电能转化为化学能的装置,故A错误;
B、因MgCl2?6H2O受热生成Mg(OH)Cl和HCl气体等,得不到无水MgCl2,若要由MgCl2?6H2O灼烧即可制得无水MgCl2,为防止Mg2+发生水解,应在HCl气氛中进行,故B错误;
C、根据化学反应:2Br-+Cl2 =Br2 +2Cl-,可以知道每氧化0.2molBr-需消耗0.1molCl2,故C正确;
D、因Br2+SO2 +2H2O=2HBr+H2SO4,反应后溶液呈酸性,能与金属容器反应,需解决其对金属设备的腐蚀问题,故D错误;
故选C.
B、因MgCl2?6H2O受热生成Mg(OH)Cl和HCl气体等,得不到无水MgCl2,若要由MgCl2?6H2O灼烧即可制得无水MgCl2,为防止Mg2+发生水解,应在HCl气氛中进行,故B错误;
C、根据化学反应:2Br-+Cl2 =Br2 +2Cl-,可以知道每氧化0.2molBr-需消耗0.1molCl2,故C正确;
D、因Br2+SO2 +2H2O=2HBr+H2SO4,反应后溶液呈酸性,能与金属容器反应,需解决其对金属设备的腐蚀问题,故D错误;
故选C.
点评:本题考查了海水资源综合利用,涉及了离子的除杂、离子水解、氧化还原反应、元素及其化合物的有关知识进行综合利用,提高了试题的综合性,本题难度中等.

练习册系列答案
相关题目