题目内容
【题目】Na2S2O35H2O在化学定量分析中常用作基准物质,实验室制备原理为:Na2CO3 + 4SO2 + 2Na2S![]() 3Na2S2O3+ CO2设计如图1装置
3Na2S2O3+ CO2设计如图1装置![]() 夹持仪器省略
夹持仪器省略![]() 进行实验。
进行实验。
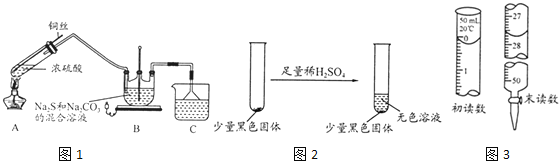
⑴A中发生的化学反应方程式为 ______;
⑵C中所盛试剂可能是 ______;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是 ______;
⑶学生乙在加热A后,发现液面下的铜丝变黑,如图2。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS。
学生丙提出假设②一定不成立,依据是 ______;该生用如下实验进一步验证黑色物质的组成:基于上述假设分析,黑色物质的组成为 ______ (填化学式)
⑷实验室用Na2S2O3标准液测量某工业废水中的I2的浓度。
已知:I2 + 2S2O32- = S4O62- + 2I-
①以淀粉为指示剂,则到达滴定终点的现象是 ______ ;
②若标液Na2S2O3的浓度0.0030mol/L,滴定25.00 mL工业废水消耗该Na2S2O3溶液体积如右图所示,则该废水中I2的浓度为 ______ 。
【答案】Cu +2CuSO4(浓) ![]() CuSO4+ SO2↑+2H2O NaOH溶液 将铜丝抽离液面停止反应 Cu2O为砖红色 CuS 滴入最后一滴,溶液由蓝色变为无色,且半分钟内不变色 0.0017mol/L
CuSO4+ SO2↑+2H2O NaOH溶液 将铜丝抽离液面停止反应 Cu2O为砖红色 CuS 滴入最后一滴,溶液由蓝色变为无色,且半分钟内不变色 0.0017mol/L
【解析】
⑴加热条件下,Cu和浓硫酸反应生成CuSO4、SO2和H2O。
⑵SO2有毒,不能直接排空,且为酸性氧化物,能和碱溶液反应;将Cu和浓硫酸分离而停止反应。
⑶Cu2O为砖红色不是黑色;黑色固体CuS不溶于稀硫酸。
⑷①碘遇淀粉试液变蓝色;②根据关系式进行计算。
⑴加热条件下,Cu和浓硫酸反应生成CuSO4、SO2和H2O,反应方程式为Cu +2CuSO4(浓) ![]() CuSO4+ SO2↑+2H2O,故答案为:Cu +2CuSO4(浓)
CuSO4+ SO2↑+2H2O,故答案为:Cu +2CuSO4(浓) ![]() CuSO4+ SO2↑+2H2O。
CuSO4+ SO2↑+2H2O。
⑵SO2有毒,不能直接排空,且为酸性氧化物,能和碱溶液反应生成无毒亚硫酸盐,所以可以碱液吸收二氧化硫尾气,如NaOH溶液;还可以将Cu和浓硫酸分离而停止反应,故答案为:NaOH溶液;将铜丝抽离液面停止反应。
⑶Cu2O为砖红色不是黑色,所以②一定不成立;CuO能溶于稀硫酸生成蓝色CuSO4溶液,黑色固体CuS不溶于稀硫酸,所以该黑色固体是CuS,故答案为:Cu2O为砖红色;CuS。
⑷①碘遇淀粉试液变蓝色,如果滴入最后一滴,溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点,故答案为:滴入最后一滴,溶液由蓝色变为无色,且半分钟内不变色。
②V(Na2S2O3)= (27.70 mL – 0.20 mL)=27.50 mL,设碘的物质的量浓度是xmol/L,
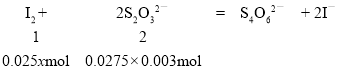
解得x = 0.0017。故答案为:0.0017mol/L

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol·L-1 盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验玻璃用品是______,______。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?为什么?__________。
(3)他们记录的实验数据如下:已知:![]()
①计算完成下表。(保留小数点后一位)
序号 | 实验用品 | 溶液温度 | 温度差平均值 | ||
t 1 | t 2 | ||||
1 | 50 mL0.55mol·LNaOH | 50 mL0.5mol·LHCl | 20℃ | 23.3℃ | _____ |
2 | 50 mL0.55mol·LNaOH | 50 mL0.5mol·LHCl | 20℃ | 23.5℃ | |
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:______________。
(4)若用KOH代替NaOH,对测定结果________(填“有”或“无”)影响;若用醋酸代替HCl做实验,测定所得的中和热的数值将________(填“变大”或“变小”或“无影响”)。
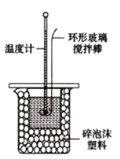
【题目】实验室用50mL 0.50mol/L盐酸、50mL0.55mol/L NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度/℃ | 终止温度/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是___。实验中使用环形玻璃搅拌棒的操作方法是____;
(2)在操作正确的前提下,提高中和热测定准确性的关键是_____;
(3)根据表中所测数据进行计算,则该实验测得的中和热![]() =_____ [盐酸和NaOH溶液的密度按1
=_____ [盐酸和NaOH溶液的密度按1![]() 计算,反应后混合溶液的比热容(c)按4.18
计算,反应后混合溶液的比热容(c)按4.18![]() 计算]。如果用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的中和热将______ (填“偏大”“偏小”或“不变”)。
计算]。如果用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的中和热将______ (填“偏大”“偏小”或“不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热数值偏低,请你分析可能的原因是__________;
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 C.做本实验的当天室温较高 D.在量取盐酸时仰视读数 E.大烧杯的盖板中间小孔太大