题目内容
为了证明一氧化碳具有还原性,有人设计了下列实验:
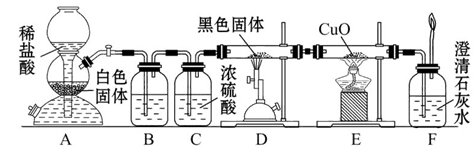
(1)装置B中最适宜的试剂是___________________________________________。
(2)装置D中发生反应的化学方程式是___________________________________。
(3)必须用装置C吸收除去气体中水蒸气的理由是_________________________。
(4)若根据F中石灰水变浑浊的现象也能确定CO具有还原性,应在上图中装置______与______之间连接下列装置中的______(填序号)。
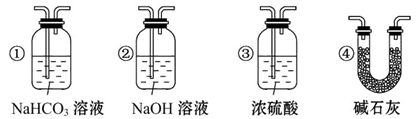

(1)装置B中最适宜的试剂是___________________________________________。
(2)装置D中发生反应的化学方程式是___________________________________。
(3)必须用装置C吸收除去气体中水蒸气的理由是_________________________。
(4)若根据F中石灰水变浑浊的现象也能确定CO具有还原性,应在上图中装置______与______之间连接下列装置中的______(填序号)。

(1)饱和NaHCO3溶液
(2)CO2+C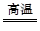 2CO
2CO
(3)水蒸气进入D中在高温下能跟碳反应产生H2,H2也能使CuO还原,不能证明CO具有还原性
(4)D E ④
(2)CO2+C
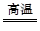 2CO
2CO(3)水蒸气进入D中在高温下能跟碳反应产生H2,H2也能使CuO还原,不能证明CO具有还原性
(4)D E ④
(1)装置B用来除去HCl,最适宜的试剂是饱和NaHCO3溶液。
(2)装置D中发生反应的化学方程式是
CO2+C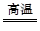 2CO。
2CO。
(3)水蒸气进入D中在高温下能跟碳反应产生H2,H2也能使CuO还原,故不能证明CO具有还原性,所以必须用装置C除去气体中的水蒸气。
(4)若根据F中石灰水变浑浊的现象也能确定CO具有还原性,应在上图中装置D与E之间连接装置④,以除去其中的CO2。
验证CO具有还原性的常用实验方法是CO还原氧化铜的实验,通过黑色固体变红色,产生的气体能使澄清的石灰水变浑浊来说明。除去尾气中的CO的常用方法是点燃法。
(2)装置D中发生反应的化学方程式是
CO2+C
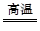 2CO。
2CO。(3)水蒸气进入D中在高温下能跟碳反应产生H2,H2也能使CuO还原,故不能证明CO具有还原性,所以必须用装置C除去气体中的水蒸气。
(4)若根据F中石灰水变浑浊的现象也能确定CO具有还原性,应在上图中装置D与E之间连接装置④,以除去其中的CO2。
验证CO具有还原性的常用实验方法是CO还原氧化铜的实验,通过黑色固体变红色,产生的气体能使澄清的石灰水变浑浊来说明。除去尾气中的CO的常用方法是点燃法。

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
 Si3N4(s)+12HCl(g) ΔH=a kJ/mol(a<0)
Si3N4(s)+12HCl(g) ΔH=a kJ/mol(a<0)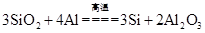
 CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1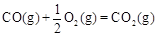 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1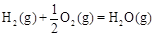 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1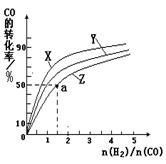
 CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。