题目内容
在标准状况下,有4.48LHCl气体,计算:
(1)标准状况下,4.48LHCl的物质的量是______mol,质量是______g.
(2)将此HC1气体全部溶于水配制500mL溶液,该溶液物质的量浓度为______mol/L,其中H+的物质的量是______mol,Cl-的物质的量是______mol.
(3)117g质量分数为10%的NaC1溶液2L,NaC1的物质的量是______mol,该溶液中C1-的物质的量浓度为______mol/L.
解:(1)标准状况下,4.48LHCl的物质的量为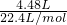 =0.2mol,故HCl的质量为0.2mol×36.5g/mol=7.3g,故答案为:0.2;7.3;
=0.2mol,故HCl的质量为0.2mol×36.5g/mol=7.3g,故答案为:0.2;7.3;
(2)所得盐酸的物质的量浓度为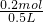 =0.4mol/L,HCl是强电解质,完全电离HCl=H++Cl-,故n(H+)=n(Cl-)=n(HCl)=0.2mol,
=0.4mol/L,HCl是强电解质,完全电离HCl=H++Cl-,故n(H+)=n(Cl-)=n(HCl)=0.2mol,
故答案为:0.4;0.2;0.2;
(3)氯化钠的质量为117g×10%=11.7g,氯化钠的物质的量为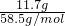 =0.2mol,氯化钠完全电离,氯离子物质的量等于氯化钠的物质的量为0.2mol,故氯离子的物质的量浓度为
=0.2mol,氯化钠完全电离,氯离子物质的量等于氯化钠的物质的量为0.2mol,故氯离子的物质的量浓度为 =0.1mol/L,故答案为:0.2;0.1.
=0.1mol/L,故答案为:0.2;0.1.
分析:(1)根据n= 计算HCl的物质的量,根据m=nM计算HCl的质量;
计算HCl的物质的量,根据m=nM计算HCl的质量;
(2)根据c= 计算所得盐酸的物质的量浓度,HCl是强电解质,完全电离,氢离子、氯离子物质的量等于HCl的物质的量;
计算所得盐酸的物质的量浓度,HCl是强电解质,完全电离,氢离子、氯离子物质的量等于HCl的物质的量;
(3)根据m(溶质)=m(溶液)×ω(溶质)计算氯化钠的质量,根据n= 计算氯化钠的物质的量,氯化钠完全电离,氯离子物质的量等于氯化钠的物质的量,根据c=
计算氯化钠的物质的量,氯化钠完全电离,氯离子物质的量等于氯化钠的物质的量,根据c= 计算氯离子的物质的量浓度.
计算氯离子的物质的量浓度.
点评:本题考查物质的量的有关计算,比较基础,注意电解质离子物质的量与电解质的物质的量关系.
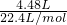 =0.2mol,故HCl的质量为0.2mol×36.5g/mol=7.3g,故答案为:0.2;7.3;
=0.2mol,故HCl的质量为0.2mol×36.5g/mol=7.3g,故答案为:0.2;7.3;(2)所得盐酸的物质的量浓度为
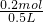 =0.4mol/L,HCl是强电解质,完全电离HCl=H++Cl-,故n(H+)=n(Cl-)=n(HCl)=0.2mol,
=0.4mol/L,HCl是强电解质,完全电离HCl=H++Cl-,故n(H+)=n(Cl-)=n(HCl)=0.2mol,故答案为:0.4;0.2;0.2;
(3)氯化钠的质量为117g×10%=11.7g,氯化钠的物质的量为
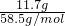 =0.2mol,氯化钠完全电离,氯离子物质的量等于氯化钠的物质的量为0.2mol,故氯离子的物质的量浓度为
=0.2mol,氯化钠完全电离,氯离子物质的量等于氯化钠的物质的量为0.2mol,故氯离子的物质的量浓度为 =0.1mol/L,故答案为:0.2;0.1.
=0.1mol/L,故答案为:0.2;0.1.分析:(1)根据n=
 计算HCl的物质的量,根据m=nM计算HCl的质量;
计算HCl的物质的量,根据m=nM计算HCl的质量;(2)根据c=
 计算所得盐酸的物质的量浓度,HCl是强电解质,完全电离,氢离子、氯离子物质的量等于HCl的物质的量;
计算所得盐酸的物质的量浓度,HCl是强电解质,完全电离,氢离子、氯离子物质的量等于HCl的物质的量;(3)根据m(溶质)=m(溶液)×ω(溶质)计算氯化钠的质量,根据n=
 计算氯化钠的物质的量,氯化钠完全电离,氯离子物质的量等于氯化钠的物质的量,根据c=
计算氯化钠的物质的量,氯化钠完全电离,氯离子物质的量等于氯化钠的物质的量,根据c= 计算氯离子的物质的量浓度.
计算氯离子的物质的量浓度.点评:本题考查物质的量的有关计算,比较基础,注意电解质离子物质的量与电解质的物质的量关系.

练习册系列答案
相关题目