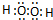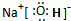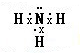题目内容
2.常温下,有Mn2+、Cl-、H+、MnO4-、Cl2和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,其中Cl2是氧化产物,下列叙述错误的是( )| A. | 氧化剂与还原剂的物质的量之比为1:5 | |
| B. | 该过程说明KMnO4酸化时不能滴加盐酸 | |
| C. | 反应过程中转移2mol电子时,产生Cl2的体积约为22.4L | |
| D. | 若把该反应设计成原电池,则正极反应为MnO4-+5e-+8H+═Mn2++4H2O |
分析 Cl2是氧化产物,Cl-具有还原性,MnO4-在酸性条件下具有强氧化性,由题意可以确定,Mn元素的化合价升高,Cl元素的化合价降低,则发生反应2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,以此来解答.
解答 解:由信息可知,发生氧化还原反应为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,
A.氧化剂为MnO4-,还原剂为HCl,由反应可知,氧化剂与还原剂的物质的量之比为1:5,故A正确;
B.高锰酸钾能氧化HCl,则该过程说明KMnO4酸化时不能滴加盐酸,故B正确;
C.由反应可知转移10mol电子生成5mol气体,反应过程中转移2mol电子时,产生Cl21mol,状况未知,不能计算体积,故C错误;
D.原电池中正极得到电子,则正极反应为MnO4-+5e-+8H+═Mn2++4H2O,故D正确;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
13.构建和谐社会的总要求之一是人与自然和谐相处,下列做法不符合这一主题的是( )
| A. | 中科院广州化学所在利用二氧化碳制取可降解塑料的技术方面处于世界领先水平,该技术的成功应用将有效改善以二氧化碳为主的温室气体引发的“厄尔尼诺”、“拉尼娜”等全球气候异常现象 | |
| B. | 许多国家对聚乙烯等塑料垃圾进行了深埋或者倾倒入海处理,达到消除“白色污染”的目的 | |
| C. | 山东单县采用以杂草、秸秆等为原料的生物质发电,有效地减少了二氧化硫的排放 | |
| D. | 汽油中掺入酒精使用,可以降低对环境的污染和节约能源 |
17.对H3O+的说法正确的是( )
| A. | O原子采取sp2杂化 | B. | H3O+离子的空间构型为平面三角形 | ||
| C. | H3O+离子中存在配位键 | D. | H3O+离子中存在非极性键 |
14.下列说法正确的是( )
| A. | KW随温度、浓度的改变而改变 | |
| B. | 凡是能自发进行的化学反应,一定是△H<0、△S>0 | |
| C. | 对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 | |
| D. | Ksp与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
11.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
| 选 项 | 操作及现象 | 溶 液 |
| A | 加入NaOH,溶液产生蓝色沉淀.再加入葡萄糖,加热,产生红色沉淀. | CuSO4溶液 |
| B | 加入NaOH,溶液产生白色沉淀.再通入CO2,白色沉淀消失. | Ca(HCO3)2溶液 |
| C | 加入NaOH,溶液紫色褪去.再加入盐酸,振荡,溶液又变成紫色. | I2的CCl4溶液 |
| D | 加入NaOH,溶液产生白色沉淀,有刺激性气味气体产生.继续加入 NaOH,沉淀消失. | KAl(SO4)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
12.下列有关生活和生产中化学知识的描述正确的是( )
| A. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 侯氏制碱法的工艺原理主要应用了物质熔沸点的差异 | |
| C. | 铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 | |
| D. | 用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气 |
 ,C元素在周期表中的位置第三周期ⅥA族.
,C元素在周期表中的位置第三周期ⅥA族. 或
或