题目内容
下列叙述不正确的是( )
A.c(
| ||
| B.欲除去CuCl2溶液中混有少量的FeCl3,可加入CuO | ||
| C.0.2mol/LHCl溶液与等体积0.05mol/LBa(OH)2溶液混合后,溶液的pH=1 | ||
D.0.2mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(
|
A、(NH4)2SO4的化学式中含有2个铵根离子,NH4HSO4和NH4Cl的化学式中都含有1个铵根离子,当铵根离子浓度相等时,硫酸铵的浓度小于硫酸氢铵和氯化铵的浓度,硫酸氢铵溶液中的氢离子能抑制铵根离子的水解,导致当铵根离子浓度相等时,硫酸氢铵的浓度小于氯化铵的浓度,所以C(
)相等的(NH4)2SO4溶液、NH4HSO4溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4HSO4]<c(NH4Cl),故A正确;
B、氯化铁水解的方程式为 FeCl3+3H2O?Fe(OH)3+3HCl,当向溶液中加氧化铜时,氧化铜和盐酸反应生成氯化铜和水,导致平衡向正反应方向移动,所以能除去氯化铁,故B正确;
C、0.2mol/LHCl溶液与等体积0.05mol/LBa(OH)2溶液混合时,盐酸和氢氧化钡的物质的量之比是4:1,发生的反应方程式为2HCl+Ba(OH)2=BaCl2+2H2O,根据方程式知,混合后盐酸剩余,混合溶液中盐酸的浓度是0.05mol/L,溶液的pH>1,故C错误;
D、0.2mol/L的NaHCO3溶液中,根据物料守恒得,c(H2CO3)+c(
)+c(HCO3-)=C(Na+)=0.2mol/L,根据溶液中电量相等得,
c(H+)+c(Na+)=2c(
)+c(OH-)+C(HCO3-)
所以得c(H+)+c(H2CO3)=c(
)+c(OH-),故D正确.
故选C.
| NH | +4 |
B、氯化铁水解的方程式为 FeCl3+3H2O?Fe(OH)3+3HCl,当向溶液中加氧化铜时,氧化铜和盐酸反应生成氯化铜和水,导致平衡向正反应方向移动,所以能除去氯化铁,故B正确;
C、0.2mol/LHCl溶液与等体积0.05mol/LBa(OH)2溶液混合时,盐酸和氢氧化钡的物质的量之比是4:1,发生的反应方程式为2HCl+Ba(OH)2=BaCl2+2H2O,根据方程式知,混合后盐酸剩余,混合溶液中盐酸的浓度是0.05mol/L,溶液的pH>1,故C错误;
D、0.2mol/L的NaHCO3溶液中,根据物料守恒得,c(H2CO3)+c(
| CO | 2-3 |
c(H+)+c(Na+)=2c(
| CO | 2-3 |
所以得c(H+)+c(H2CO3)=c(
| CO | 2-3 |
故选C.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
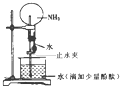 如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )
如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )| A、该实验说明氨气是一种极易溶于水的气体 | B、进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性 | C、氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化 | D、形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压 |
苯与乙烯相比较,下列叙述不正确的是( )
| A、都能燃烧,生成二氧化碳和水 | B、都容易发生加成反应 | C、乙烯易发生加成反应,苯只能在特殊条件下才发生加成反应 | D、乙烯易被酸性高锰酸钾溶液氧化,苯不能被酸性高锰酸钾溶液氧化 |