题目内容
【题目】氯气是一种有毒的气体,工业上常用浓氨水挥发出来的氨气检验氯气管道是否漏气,某学生为探究此反应原理,设计如下实验,请回答下列问题:

(1)选择上图装置,填写接口顺序_________

(2)装置D中发生反应的离子化学方程式为___________;
(3)装置E、F的作用分别是_________;__________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物为单质。写出反应的化学方程式:________;此时F中发生的离子方程式为___________。
(5)氯气程式与与氨气在水溶液中可以反应生成氯胺(NH2Cl),氯胺是一种长效缓释的杀菌消毒剂,写出氯胺与水反应的化学反应方程:___________。
【答案】 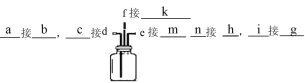 MnO2+4H++2Cl-
MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O E装置的作用是除去氯气中的杂质气体HCl F装置吸收多余的尾气 8NH3+3Cl2=6NH4Cl+N2 Cl2+HSO3-+H2O=2Cl-+3H++SO42- NH2Cl+H2O=NH3+HClO(生成NH4ClO也得分)
Mn2++Cl2↑+2H2O E装置的作用是除去氯气中的杂质气体HCl F装置吸收多余的尾气 8NH3+3Cl2=6NH4Cl+N2 Cl2+HSO3-+H2O=2Cl-+3H++SO42- NH2Cl+H2O=NH3+HClO(生成NH4ClO也得分)
【解析】(1)实验室制取NH3可选择A装置利用NH4Cl和Ca(OH)2混合加热获得,再通过碱石灰干燥;氯气可选择D装置利用浓盐酸和二氧化锰混合加热获得,并借助饱和食盐水除去挥发出的HCl,利用浓硫酸干燥氯气,在C中将氯气和氨气混合,并利用亚硫酸氢钠溶液吸收多余的氯气或氨气,防止污染空气,根据气体的流向,装置连接方法为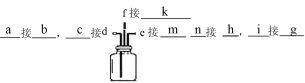 ;
;
(2)装置D中制取氯气发生反应的离子化学方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)装置E中饱和食盐水是吸收挥发出的氯气,F中亚硫酸氢钠溶液吸收多余的氯气或氨气,防止污染空气;
(4)NH3遇Cl2出现浓厚的白烟并在容器内壁凝结,说明产物为NH4Cl,同时得到的单质为N2,发生反应的化学方程式为8NH3+3Cl2=6NH4Cl+N2;因氯气有强氧化性,NaHSO3有还原性,则F中亚硫酸氢钠溶液吸收多余的氯气发生的离子方程式为Cl2+HSO3-+H2O=2Cl-+3H++SO42-;
(5)氯胺(NH2Cl)是一种长效缓释的杀菌消毒剂,是因为氯胺溶于水水解生成HClO的缘故,氯胺与水反应的化学反应方程为NH2Cl+H2O=NH3+HClO。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】下列有关物质的分类正确的是
酸性氧化物 | 一元酸 | 强电解质 | 分散系 | |
A | Mn2O7 | 丙酸 | 三氧化二铝 | 黄河水 |
B | NO2 | 高氯酸 | 盐酸 | 有色玻璃 |
C | SiO2 | 石炭酸 | 氢氧化铝 | 云、雾 |
D | SO2 | 硝酸 | 溴化氢 | 冰水混合物 |
A. AB. BC. CD. D