题目内容
【题目】(1)在一定温度下的2 L固定容积的密闭容器中,通入2 mol CO2和3 mol H2,发生的反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

①能说明该反应已达平衡状态的是_____________(填编号)。
A.单位时间内每消耗1.2 mol H2,同时生成0.4 mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1∶1,且保持不变
②若要使K=1,则改变的条件可以是_____________(填选项)。
A增大压强 B减小压强 C升高温度 D降低温度 E加入催化剂
(2)有一种用CO2生产甲醇燃料的方法。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-bkJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH=-ckJ·mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为 。
(3)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)![]() 3C(g)+2D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
3C(g)+2D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
物质 | A | B | C | D |
起始投料/mol | 2 | 1 | 3 | 0 |
该反应的平衡常数表达式为K=__________。升高温度,平衡常数将__________(填“增大”“减小”或“不变”)。
(4)为研究不同条件对反应span>2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH<0的影响,在恒温下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应达到平衡,测得NO的转化率为α1;其他条件保持不变,反应在恒压条件下进行,达到平衡时NO的转化率为α2,则α1________α2(填“大于”“小于”或“等于”)。
2ClNO(g) ΔH<0的影响,在恒温下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应达到平衡,测得NO的转化率为α1;其他条件保持不变,反应在恒压条件下进行,达到平衡时NO的转化率为α2,则α1________α2(填“大于”“小于”或“等于”)。
【答案】
(1)①BC;②D;
(2)CH3OH(l)+3/2O2(g)=CO2(g)+3H2O(l)ΔH=-(3/2c-a-b)kJ·mol-1;
(3)K=c3(C)/〔c2(A)·c(B)〕;减小;(4)小于;
【解析】
试题分析:①未平衡时是个变量,现在不变说明已经达到平衡状态了。A.单位时间内每消耗1.2mol H2,向正方向,同时生成0.4mol H2O,也向正方向,不能反映正逆反应之间的关系,故A错误;B.未平衡CO2的体积分数是个变化的量,现在混合气体CO2的体积分数保持不变,说明已经平衡了,故B正确;C.未平衡时混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故C正确;D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明各自的量不再随时间的变化而变化,故C错误;故选BC;
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始(mol/L) 1 1.5 0 0
变化(mol/L) 0.25 0.75 0.25 0.25
平衡(mol/L) 0.75 0.75 0.25 0.25
所以 K=![]() =0.20,而平衡常数是温度的函数,只有通过改变温度来改变平衡常数,正反应量放热反应,降低温度,K值变大,变化为1,故答案为:D;
=0.20,而平衡常数是温度的函数,只有通过改变温度来改变平衡常数,正反应量放热反应,降低温度,K值变大,变化为1,故答案为:D;
(2)①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
②CH3OH(g)=CH3OH(l) ΔH=-bkJ·mol-1;
③2H2(g)+O2(g)=2H2O(l) ΔH=-ckJ·mol-1;
根据盖斯定律,将![]() ×③-①-②得:CH3OH(l)+3/2O2(g)=CO2(g)+3H2O(l)
×③-①-②得:CH3OH(l)+3/2O2(g)=CO2(g)+3H2O(l)
ΔH=![]() △H3-△H1-△H2=-(
△H3-△H1-△H2=-(![]() c-a-b)kJ·mol-1,故答案为:
c-a-b)kJ·mol-1,故答案为:
CH3OH(l)+3/2O2(g)=CO2(g)+3H2O(l)ΔH=![]() △H3-△H1-△H2=-(
△H3-△H1-△H2=-(![]() c-a-b)kJ·mol-1;
c-a-b)kJ·mol-1;
(3)D为固体,该反应的平衡常数表达式为K=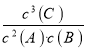 ;恒容压强与温度及其气体物质的量成正比,又由起始D的物质的量为0可知,反应2A(g)+B(g)
;恒容压强与温度及其气体物质的量成正比,又由起始D的物质的量为0可知,反应2A(g)+B(g) ![]() 3C(g)+2D(s),向正反应进行建立平衡,而气体物质的量不变,但压强增大,则说明该反应为放热反应,温度升高导致气体的压强增大。由①的分析得出该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,故答案为:
3C(g)+2D(s),向正反应进行建立平衡,而气体物质的量不变,但压强增大,则说明该反应为放热反应,温度升高导致气体的压强增大。由①的分析得出该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,故答案为: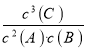 ;减小;
;减小;
(4)正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1;故答案为:小于。

【题目】硫化碱法是工业上制备Na2S2O3的方法之一,其反应原理为:2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2(该反应△H>0),某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O的流程如下。

(1)吸硫装置如图所示。

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ____________ ,表明SO2吸收效率低的实验现象是B中溶液 _________________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 __________________ 。(答一条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)。
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, _________。 | 有白色沉淀生成 | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,________。 | 有白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(相对分子质量为214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步: 用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。
则c(Na2S2O3)=_________mol·L-1。
已知:IO3-+5I-+6H+= 3I2+3H2O ,2S2O32-+I2=S4O62-+2I-
(4)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能__________(填“不受影响”、“偏低”或“偏高”),原因是_________________________________。(用离子方程式表示)。
【题目】下列除杂试剂或方法不正确的是( )
选项 | 被提纯物质 | 杂质 | 除杂试剂或方法 |
A | FeCl3溶液 | FeCl2 | 通入适量Cl2 |
B | FeCl2溶液 | FeCl3 | 加入过量铁粉并过滤 |
C | 铁粉 | 铝粉 | 加入过量NaOH溶液并过滤 |
D | Fe(OH)3 | Fe(OH)2 | 在空气中灼烧 |
A. A B. B C. C D. D
【题目】碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82- + 2I- = 2SO42- + I2(慢) I2 + 2S2O32- = 2I- + S4O62- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的__________耗尽后,溶液颜色将由无色变成为蓝色。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验 序号 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx=_____________mL,理由是_________________。
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~t的变化曲线示意图(进行相应地标注)__________。
