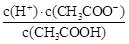题目内容
关于pH相同的醋酸和盐酸溶液,下列叙述不正确的是
| A.取等体积的两种酸分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸 |
| B.取等体积的两种酸溶液分别稀释至原溶液的m倍和n倍,稀释后两溶液的pH仍然相同,则m>n |
| C.取等体积的两种酸溶液分别与足量的锌粒反应,生成氢气的体积醋酸大于盐酸 |
| D.取等体积的两种酸溶液分别与NaOH溶液中和,消耗NaOH的物质的量醋酸大于盐酸 |
A
醋酸是弱电解质,所以在pH相等的条件下,醋酸的浓度大于盐酸的。选项A不正确,开始时,氢离子浓度相等,反应速率相等;在稀释过程中,醋酸的电离是促进的,所以要使稀释后两溶液的pH仍然相同,则醋酸加的水要多,B正确;醋酸的浓度大,在体积相等的条件下,醋酸产生的氢气多,同样消耗的氢氧化钠也是多,C、D正确,答案选A。

练习册系列答案
相关题目
 H+(溶液)+ In-(黄色溶液)
H+(溶液)+ In-(黄色溶液)
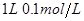 醋酸
醋酸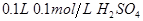 溶液
溶液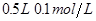 盐酸
盐酸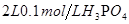 溶液
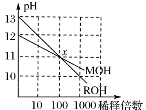
溶液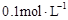 的醋酸至
的醋酸至 ,稀释过程中温度维持25℃不变,下列各项中始终保持增大趋势的是 ( )
,稀释过程中温度维持25℃不变,下列各项中始终保持增大趋势的是 ( ) c(OH— )
c(OH— )