题目内容
9.下列说法中,不符合ⅦA族元素性质特征的是( )| A. | 从上到下原子半径逐渐增大 | B. | 易形成-1价离子 | ||
| C. | 最高价氧化物的水化物显酸性 | D. | 从上到下氢化物的稳定性依次减弱 |
分析 ⅦA族元素原子最外层有7个电子,发生化学反应时容易得到1个电子而达到稳定结构,根据元素周期律的递变规律可知,同主族元素从上到下元素的非金属性逐渐减弱,对应氢化物的稳定性逐渐减弱,从上到下原子半径逐渐增大,以此来解答.
解答 解:A.同主族元素从上到下原子核外电子层数逐渐增多,则半径逐渐增大,故A正确;
B.ⅦA族元素原子最外层有7个电子,发生化学反应时容易得到1个电子而达到稳定结构,易形成-1价离子,故B正确;
C.F没有正价,不存在最高价氧化物的水化物,除F外最高价氧化物的水化物显酸性,故C错误;
D.同主族元素从上到下元素的非金属性逐渐减弱,对应氢化物的稳定性逐渐减弱,故D正确;
故选C.
点评 本题考查同主族元素的递变规律,为高频考点,注意把握元素周期律的递变规律为解答的关键,注意选项C为易错点,题目难度不大.

练习册系列答案
相关题目
19.下列有机物命名正确的是( )
| A. |  2-甲基-2-氯丙烷 | B. |  1,3,4-三甲苯 | C. | 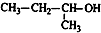 2-甲基-1-丙醇 | D. |  2-甲基-3-丁炔 |
17.在N2+3H2?2NH3的反应中,经过一段时间,NH3的浓度增加了0.6mol/L,在此段时间内用H2表示的平均反应速率为0.45mol/(L•S),则所经过的时间是( )
| A. | 1s | B. | 2s | C. | 0.44s | D. | 1.33s |
4.在学习苯的化学反应时,我们得出的结论是苯易发生取代反应,难发生加成反应,下列物质中,苯基最容易发生取代反应的是( )
| A. | 苯 | B. | 甲苯 | C. | 苯甲醇 | D. | 苯酚 |
14.烷烃 是由某单烃与H2加成后的产物,(考虑时包括烯烃的顺反异构),则这种但烯烃的结构可能有( )
是由某单烃与H2加成后的产物,(考虑时包括烯烃的顺反异构),则这种但烯烃的结构可能有( )
 是由某单烃与H2加成后的产物,(考虑时包括烯烃的顺反异构),则这种但烯烃的结构可能有( )
是由某单烃与H2加成后的产物,(考虑时包括烯烃的顺反异构),则这种但烯烃的结构可能有( )| A. | 4种 | B. | 5种 | C. | 7种 | D. | 9种 |
18.下列物质一定互为同系物的是( )
| A. | C2H4和C3H4 | B. | C2H6和C4H10 | C. | CH2O2和C2H4O2 | D. | C2H2和C6H6 |
19.(1)下列物质属于弱电解质的是④⑦(填序号,下同);属于非电解质的是②⑤;能导电的物质是①⑧⑩.
①氨水②蔗糖 ③烧碱 ④NH3•H2O ⑤CO2 ⑥氯气 ⑦CH3COOH ⑧铜 ⑨碳酸钙 ⑩石墨
(2)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO${\;}_{3}^{-}$+5SO${\;}_{3}^{2-}$+2H+═I2+5SO${\;}_{4}^{2-}$+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
①碘酸钾与亚硫酸钠的反应是氧化还原反应(填反应类型).
②该实验的两个目的分别是探究温度对反应速率的影响;探究Na2SO3的浓度对反应速率的影响.
③表中V2=40mL,V1=10mL.
④t1<t2<t3(填“<”、“>”或“=”).
①氨水②蔗糖 ③烧碱 ④NH3•H2O ⑤CO2 ⑥氯气 ⑦CH3COOH ⑧铜 ⑨碳酸钙 ⑩石墨
(2)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO${\;}_{3}^{-}$+5SO${\;}_{3}^{2-}$+2H+═I2+5SO${\;}_{4}^{2-}$+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
| 0.01mol•L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol•L-1 Na2SO3溶液的体积/mL | H2O的体 积/mL | 实验温 度/℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t 1 |
| 实验2 | 5 | 5 | 40 | 25 | t 2 |
| 实验3 | 5 | 5 | V2 | 0 | t 3 |
②该实验的两个目的分别是探究温度对反应速率的影响;探究Na2SO3的浓度对反应速率的影响.
③表中V2=40mL,V1=10mL.
④t1<t2<t3(填“<”、“>”或“=”).
 ;
;