题目内容
常温下,一种烷烃A和一种单烯烃B组成的混合气体,A或B分子最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
(1)将1L混合气体充分燃烧,在同温同压下得到2.5LCO2气体。试通过计算推断原混合气体中A和B所有可能的组合及其体积比,并将结果填入下表:
为进一步确定A、B分子式,继续实验:
(2)120℃时,取1L该混合气体与9L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大了6.25﹪。试通过计算确定唯一符合题意的A、B的分子式。
(1)将1L混合气体充分燃烧,在同温同压下得到2.5LCO2气体。试通过计算推断原混合气体中A和B所有可能的组合及其体积比,并将结果填入下表:
| 组合编号 | A的分子式 | B的分子式 | A和B的体积比(VA :VB) |
| ① | | | |
| ② | | | |
| ③ | | | |
| ④ | | | |
为进一步确定A、B分子式,继续实验:
(2)120℃时,取1L该混合气体与9L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大了6.25﹪。试通过计算确定唯一符合题意的A、B的分子式。
(1)(分子式各0.5分,体积比各1分,共8分)
(2)C2H6、C4H8
| 组合编号 | A的分子式 | B的分子式 | A和B的体积比(VA :VB) |
| ① | CH4 | C3H6 | 1 :3 |
| ② | CH4 | C4H8 | 1 :1 |
| ③ | C2H6 | C3H6 | 1 :1 |
| ④ | C2H6 | C4H8 | 3 :1 |
(2)C2H6、C4H8
试题分析:(1)因1升混合气体充分燃烧后生成2.5升CO2,且B分子的碳原子数比A分子的多,混合气体只能由碳原子数小于2.5的烷烃(CH4和C2H6)和碳原子数大于2.5的烯烃(C3H6和C4H8)组成,它们有四种可能的组合:CH4、C3H6;CH4、C4H8;C2H6、C3H6;C2H6、C4H8;根据每一种组合中烷烃和烯烃的碳原子数及燃烧后生成的CO2体积,可确定A和B的体积比.如:
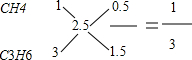 ,则V(CH4):V(C3H6)=1:3,以此类推可②CH4、C4H8、1:1③C2H6、C3H6、1:1④C2H6、C4H8、3:1;
,则V(CH4):V(C3H6)=1:3,以此类推可②CH4、C4H8、1:1③C2H6、C3H6、1:1④C2H6、C4H8、3:1;(2)设1升气态烃与氧充分燃烧后体积变化为△V升,则
CH4+2O2
 CO2+2H2O(气) △V1=0(升)
CO2+2H2O(气) △V1=0(升)C2H6+
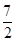 O2
O2 2CO2+3H2O(气)△V2=0.5(升)
2CO2+3H2O(气)△V2=0.5(升)C3H6+
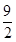 O2
O2 3CO2+3H2O(气)△V3=0.5(升)
3CO2+3H2O(气)△V3=0.5(升)C4H8+6O2
 4CO2+4H2O(气)△V4=1.0(升)
4CO2+4H2O(气)△V4=1.0(升)各种组合的1升混合气体与氧气充分燃烧,体积增大为组合①
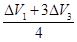 =0.375(升)
=0.375(升)组合②
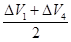 =0.5(升)
=0.5(升)组合③
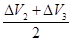 =0.5(升)
=0.5(升)组合④
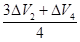 =0.625(升)
=0.625(升)则
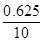 ×100%=6.25%
×100%=6.25%故组合④符合题意,即A:C2H6;B:C4H8。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目