题目内容
14.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe,有关该电池的下列说法中,正确的是( )| A. | 该电池工作时,电子由Al电极经外电路流向Li电极 | |
| B. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| C. | 负极的电极反应式为Al-3e-═Al3+ | |
| D. | 电解质溶液可以是氢氧化钠溶液或者稀硫酸 |
分析 Li-Al/FeS电池是一种二次电池,Li和Al都属于金属,合金中Li较Al活泼,根据正极反应式知,原电池的电极材料Li-Al/FeS,判断出负极材料为Li,发生反应为:Li-e-=Li+,又知该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe,所以电池反应为:2Li+FeS=Li2S+Fe,据此分析.
解答 解:A.Li-Al/FeS电池中,电子由负极Li极经外电路流向正极,故A错误;
B.根据正极反应2Li++FeS+2e-=Li2S+Fe与负极反应2Li-2e-=2Li+相加可得反应的电池反应式为:2Li+FeS=Li2S+Fe,故B正确;
C.负极材料为Li,发生反应为:Li-e-=Li+,故C错误;
D.稀硫酸和锂及硫化亚铁都能反应,所以不能用稀硫酸作电解质溶液,故D错误.
故选B.
点评 本题涵盖原电池的主体内容,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.

练习册系列答案
相关题目
4.有如下反应

下列说法正确的是( )

下列说法正确的是( )
| A. | 荧光素属于高分子化合物 | |
| B. | 荧光素与氧化荧光素都至少有6个碳原子共平面 | |
| C. | 荧光素与氧化荧光素都能与碳酸氢钠反应 | |
| D. | 荧光素与氧化荧光素互为同系物 |
5.下列说法中不正确的是( )
①任何化学反应都伴有能量变化
②根据能量守恒定律,反应物的总能量等于生成物的总能量
③化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
④煤转化为煤气后燃烧,可以提高燃烧效率
⑤等质量的氢气燃烧生成水蒸气所放出的热量低于生成液态水所放出的热量
⑥等质量的硫蒸气和硫粉分别与氧气反应生成SO2气体,硫粉放出的热量多.
①任何化学反应都伴有能量变化
②根据能量守恒定律,反应物的总能量等于生成物的总能量
③化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
④煤转化为煤气后燃烧,可以提高燃烧效率
⑤等质量的氢气燃烧生成水蒸气所放出的热量低于生成液态水所放出的热量
⑥等质量的硫蒸气和硫粉分别与氧气反应生成SO2气体,硫粉放出的热量多.
| A. | ①③⑤ | B. | ①②③④⑤⑥ | C. | ②⑥ | D. | ②③④⑥ |
2.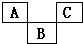 如图为元素周期表的一部分,A、B、C均为短周期元素.B的最高价氧化物的水化物为H3BO4,则A、B、C依次是( )
如图为元素周期表的一部分,A、B、C均为短周期元素.B的最高价氧化物的水化物为H3BO4,则A、B、C依次是( )
 如图为元素周期表的一部分,A、B、C均为短周期元素.B的最高价氧化物的水化物为H3BO4,则A、B、C依次是( )
如图为元素周期表的一部分,A、B、C均为短周期元素.B的最高价氧化物的水化物为H3BO4,则A、B、C依次是( )| A. | C、A1、P | B. | N、Si、S | C. | C、P、O | D. | F、S、Ar |
6.已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.
请根据信息回答有关问题:
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子;
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C;
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4;
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀.此配合物最可能是B;
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x的值为4;
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2═N2+6H2O.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子;
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C;
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4;
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀.此配合物最可能是B;
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x的值为4;
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2═N2+6H2O.
3.下列有关物质的俗名正确的是( )
| A. | Na2CO3→纯碱、小苏打 | B. | CuSO4→胆矾、蓝矾 | ||
| C. | KAl(SO4)2•12H2O→明矾 | D. | Fe3O4→铁红 |
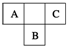 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.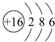 ,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).
,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).
 ;
;