题目内容
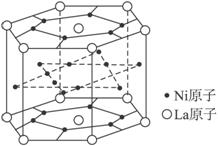
氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示。则这种合金的化学式为( )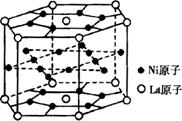
A.LaNi6 B.LaNi
D
【解析】本题容易根据均摊法的规则(顶点算![]() ,棱中点算
,棱中点算![]() ,面心算
,面心算![]() ,体心算1)错选C项,错选原因是忽视了该晶胞为平行六面体,顶点位置的离子算
,体心算1)错选C项,错选原因是忽视了该晶胞为平行六面体,顶点位置的离子算![]() 。
。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
氢气是重要而洁净的能源,要利用氢气作能源,必须安
全有效地储存氢气。
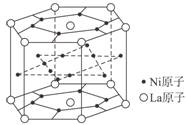
(1)某种铜镍合金材料有较大的储氢容量,
其晶体结构如图所示。这种合金中La与Ni
的原子个数比为 ;其中基态Ni
原子的核外电子排布式为 。
(2)氢元素可与其他四种短周期元素a、b、c、d、e、f、g等七种微粒,它们都有10个电子,其填结构特点如下表:
| 微粒 | a | b | c | d | e | f | g |
| 原子核数 | 双核 | 双核 | 三核 | 四核 | 四核 | 五核 | 五核 |
| 所带单位电荷 | 0 | -1 | 0 | 0 | +1 | | +1 |
①与c互为等电子体的一种阴离子是 (填化学式);
②微粒中中心原子的杂化方式为 杂化。
③比较相同条件下a与f在水中的溶解度:a f(填“>”、“=”或“<”)
 ④Ni2+可与d形成配位数为6的配离子,该配离子的化学式为 。
④Ni2+可与d形成配位数为6的配离子,该配离子的化学式为 。 A.氢气是重要而洁净的能源,要利用氢气作能源,必须安
全有效地储存氢气。
(1)某种铜镍合金材料有较大的储氢容量,
其晶体结构如图所示。这种合金中La与Ni
的原子个数比为 ;其中基态Ni
原子的核外电子排布式为 。
(2)氢元素可与其他四种短周期元素a、b、c、d、e、f、g等七种微粒,它们都有10个电子,其填结构特点如下表:
| 微粒 | a | b | c | d | e | f | g |
| 原子核数 | 双核 | 双核 | 三核 | 四核 | 四核 | 五核 | 五核 |
| 所带单位电荷 | 0 | -1 | 0 | 0 | +1 | +1 |
①与c互为等电子体的一种阴离子是 (填化学式);
②微粒中中心原子的杂化方式为 杂化。
③比较相同条件下a与f在水中的溶解度:a f(填“>”、“=”或“<”)
 ④Ni2+可与d形成配位数为6的配离子,该配离子的化学式为 。
④Ni2+可与d形成配位数为6的配离子,该配离子的化学式为 。