题目内容
【题目】亚氯酸(HClO2)是一种中强酸,易分解,亚氯酸及其盐类在工业生产和环境治理等方面用途非常广泛。回答下列问题:
(1)HClO2中氯元素的化合价为_______;亚氯酸不稳定,易分解为Cl2、ClO2和H2O,分解后的氧化产物与还原产物的物质的量之比为__________________。
(2)已知常温下Ka(HClO2)=1.1×10-2,则反应HClO2+OH-![]() ClO2-+H2O在常温下的平衡常数K=_________________。
ClO2-+H2O在常温下的平衡常数K=_________________。
(3)亚氯酸盐可用于脱除氮氧化物和硫氧化物,当其他条件不变时,测得脱除率与吸收液pH的关系如图所示。已知:C12和ClO2溶于水后更易与SO2和NO反应。

①亚氯酸盐脱除SO2的离子方程式为________________________。
②pH越小,脱除率越大,其原因是____________________________________________。
【答案】 +3 6∶1 1.1×1012 2SO2 +C1O2-+2H2O==2SO42-+C1-+4H+ 亚氯酸盐的氧化性在酸性条件下较强,pH较小时有利于释放出C1O2及Cl2,C1O2和Cl2溶于水可提高脱除率
【解析】(1)本题考查得失电子数目守恒和化学用语,HClO2中H显+1价,O显-2价,整个化合价代数和为0,即Cl显+3价,Cl→Cl2,化合价由+3价→0,因此Cl2为还原产物,Cl→+4价,化合价由+3价→+4价,化合价升高,ClO2为氧化产物,根据得失电子守恒,n(Cl2)×2×3=n(ClO2)×1,因此有n(ClO2):n(Cl2)=6:1;(2)考查平衡常数的计算,根据平衡常数的表达式,K=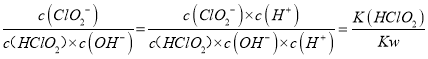 ,代入数值,解得K=1.1×1012;(3)本题考查氧化还原方程式的书写,①因为Cl2和ClO2能与SO2发生反应,因此ClO2-转化成Cl-,SO2被氧化成SO42-,因此离子反应方程式为2SO2 +C1O2-+2H2O=2SO42-+C1-+4H+;② 根据题中信息,亚氯酸盐的氧化性在酸性条件下较强,pH较小时有利于释放出ClO2及Cl2,C1O2和Cl2溶于水可提高脱除率。
,代入数值,解得K=1.1×1012;(3)本题考查氧化还原方程式的书写,①因为Cl2和ClO2能与SO2发生反应,因此ClO2-转化成Cl-,SO2被氧化成SO42-,因此离子反应方程式为2SO2 +C1O2-+2H2O=2SO42-+C1-+4H+;② 根据题中信息,亚氯酸盐的氧化性在酸性条件下较强,pH较小时有利于释放出ClO2及Cl2,C1O2和Cl2溶于水可提高脱除率。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案【题目】下列实验操作或事实与预期实验目的或所得结论对应错误的是
选项 | 实验操作或事实 | 实验目的或结论 |
A | 淡黄色试液 | 说明原溶液中一定含有Fe3+ |
B | CaO | 实验室用生石灰制备NaOH溶液 |
C | 新收集的酸雨 | 酸雨中可能含有H2SO3 |
D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于二元酸 |
A. A B. B C. C D. D


