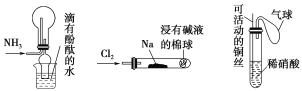
题目内容
【题目】连二亚硫酸钠(![]() )俗称保险粉,是一种强还原剂,工业上可通过吸收大气污染物(含有
)俗称保险粉,是一种强还原剂,工业上可通过吸收大气污染物(含有![]() 、NO等)制取,同时还可得到
、NO等)制取,同时还可得到![]() 产品,工艺流程图如下(Ce为铈元素):
产品,工艺流程图如下(Ce为铈元素):
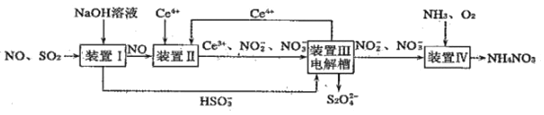
请回答下列问题:
(1)装置Ⅰ中可生成![]() 。常温下
。常温下![]() 溶液呈酸性的原因是_____________。
溶液呈酸性的原因是_____________。
(2)装置Ⅱ中酸性条件下,NO被![]() 氧化为
氧化为![]() 时,氧化产物与还原产物的物质的量之比为_______________。
时,氧化产物与还原产物的物质的量之比为_______________。
(3)装置Ⅲ中阴极上的电极反应式为_______________。若装置Ⅳ中![]() 的浓度为11.5g·
的浓度为11.5g·![]() ,要使1
,要使1![]() 该溶液中的
该溶液中的![]() 完全转化为
完全转化为![]() ,至少向装置Ⅳ中通入标准状况下的
,至少向装置Ⅳ中通入标准状况下的![]() ____________L。
____________L。
(4)![]() 在空气中容易被氧化,其反应方程式可能为:
在空气中容易被氧化,其反应方程式可能为:
①![]() ;
;
②![]() 。
。
请设计实验证明氧化时一定有反应②发生____________。
(5)![]() 一空气质子交换膜燃料电池原理示意图如下:
一空气质子交换膜燃料电池原理示意图如下:
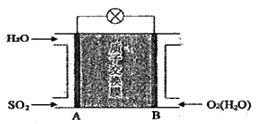
质子的流动方向为____________(“从A到B”或“从B到A”),负极的电极反应式为____________________。
【答案】 HSO3-在溶液中存在电离平衡和水解平衡:HSO3-![]() SO32-+H+,HSO3-+H2O
SO32-+H+,HSO3-+H2O![]() H2SO3+OH-,由于HSO3-的电离程度大于水解程度,故溶液中的c(H+)>c(OH-),溶液呈酸性 1:3 2HSO3-+2e-+2H+=S2O42-+2H2O 2.8 取少量固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明是②(或取少量固体溶于水中,若闻到刺激性气味,则证明是②) 从A到B SO2-2e- +2H2O=SO42-+4H+
H2SO3+OH-,由于HSO3-的电离程度大于水解程度,故溶液中的c(H+)>c(OH-),溶液呈酸性 1:3 2HSO3-+2e-+2H+=S2O42-+2H2O 2.8 取少量固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明是②(或取少量固体溶于水中,若闻到刺激性气味,则证明是②) 从A到B SO2-2e- +2H2O=SO42-+4H+
【解析】试题分析:本题以Na2S2O4的制备流程为载体,考查流程的分析、盐溶液酸碱性的判断、氧化还原反应的计算、电极反应式的书写、原电池原理和实验方案的设计。
(1)装置I中发生的反应为SO2+NaOH=NaHSO3。NaHSO3属于弱酸的酸式盐,在NaHSO3溶液中HSO3-既存在电离平衡HSO3-![]() H++SO32-又存在水解平衡HSO3-+H2O
H++SO32-又存在水解平衡HSO3-+H2O![]() H2SO3+OH-,由于HSO3-的电离程度大于水解程度,溶液中c(H+)
H2SO3+OH-,由于HSO3-的电离程度大于水解程度,溶液中c(H+)![]() c(OH-),溶液呈酸性。
c(OH-),溶液呈酸性。
(2)根据流程,NO被Ce4+氧化为NO3-,N元素的化合价由+2价升至+5价,NO3-为氧化产物,Ce4+被还原为Ce3+,Ce3+为还原产物,根据得失电子守恒,3n(NO3-)=n(Ce3+),n(NO3-):n(Ce3+)=1:3,即氧化产物与还原产物物质的量之比为1:3。
(3)在装置III的电解槽中发生电解反应,Ce3+被氧化成Ce4+,HSO3-被还原成S2O42-,S元素的化合价由+4价降至+3价,阴极电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O。装置IV中NO2-被氧化成NO3-,N元素的化合价由+3价升至+5价,根据得失电子守恒,2n(NO2-)=4n(O2),n(O2)=![]() n(NO2-)=
n(NO2-)=![]() =0.125mol,至少向装置IV中通入标准状况下O2的体积为0.125mol
=0.125mol,至少向装置IV中通入标准状况下O2的体积为0.125mol![]() 22.4L/mol=2.8L。
22.4L/mol=2.8L。
(4)根据反应的原理,要证明氧化时反应②一定发生,即检验固体中含NaHSO4。证明氧化时一定有反应②发生的实验方案为:取少量固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明一定有反应②发生(或取少量固体溶于水中,若闻到刺激性气味,则证明一定有反应②发生)。
(5)通入O2的B电极为正极,正极电极反应式为O2+4e-+4H+=2H2O;通入SO2的A电极为负极,原电池中阳离子向正极移动,质子的流动方向从A到B。负极上SO2被氧化成H2SO4,1molSO2失去2mol电子生成1molSO42-,负极电极反应式为SO2-2e-+2H2O=SO42-+4H+。

 名校课堂系列答案
名校课堂系列答案【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快