题目内容
标准状态下,向100mL2mol/L的NaOH溶液中通入CO2气体3.36L,反应后溶液中溶质的质量是多少?
【答案】分析:CO2与NaOH溶液反应有如下情况:
若n(NaOH):n(CO2)≥2,按反应①CO2+2NaOH=Na2CO3+H2O进行,等于2恰好反应,溶液中溶质为Na2CO3,若大于2,NaOH有剩余,溶液中溶质为Na2CO3、NaOH.
若n(NaOH):n(CO2)≤1,按反应②CO2+NaOH=NaHCO3进行,等于1恰好反应,溶液中溶质为NaHCO3,若小于2,CO2有剩余,溶液中溶质为NaHCO3.
若1<n(NaOH):n(CO2)<2,按反应①CO2+2NaOH=Na2CO3+H2O、②CO2+NaOH=NaHCO3进行,NaOH、CO2无剩余,恰好反应,溶液中溶质为Na2CO3、NaHCO3.
100mL2mol/L的NaOH溶液中n(NaOH)=0.1L×2mol/L=0.2mol,3.36LCO2气体的物质的量n(CO2)=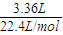 =0.15mol,
=0.15mol,
n(NaOH):n(CO2)=0.2mol:0.15mol=1:0.75,故反应CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,NaOH、CO2无剩余,恰好反应,溶液中溶质为Na2CO3、NaHCO3.令溶液中Na2CO3、NaHCO3的物质的量分别为amol、bmol,根据钠元素守恒、碳元素守恒列方程计算a、b的值,再根据m=nM计算质量.
解答:解:100mL2mol/L的NaOH溶液中n(NaOH)=0.1L×2mol/L=0.2mol,3.36LCO2气体的物质的量n(CO2)=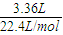 =0.15mol,n(NaOH):n(CO2)=0.2mol:0.15mol=1:0.75,故反应CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,NaOH、CO2无剩余,恰好反应,溶液中溶质为Na2CO3、NaHCO3.
=0.15mol,n(NaOH):n(CO2)=0.2mol:0.15mol=1:0.75,故反应CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,NaOH、CO2无剩余,恰好反应,溶液中溶质为Na2CO3、NaHCO3.
令溶液中Na2CO3、NaHCO3的物质的量分别为amol、bmol,则:
根据钠元素守恒有2a+b=0.2
根据碳元素守恒有a+b=0.15
联立解得:a=0.05,b=0.1
所以反应后溶液中溶质的质量为0.05mol×106g/mol+0.1mol×84g/mol=13.7g
答:反应后溶液中溶质的质量为13.7g.
点评:本题考查根据方程式的计算,难度中等,判断发生的反应是解题的关键,可以利用过程法解答,但较麻烦.
若n(NaOH):n(CO2)≥2,按反应①CO2+2NaOH=Na2CO3+H2O进行,等于2恰好反应,溶液中溶质为Na2CO3,若大于2,NaOH有剩余,溶液中溶质为Na2CO3、NaOH.
若n(NaOH):n(CO2)≤1,按反应②CO2+NaOH=NaHCO3进行,等于1恰好反应,溶液中溶质为NaHCO3,若小于2,CO2有剩余,溶液中溶质为NaHCO3.
若1<n(NaOH):n(CO2)<2,按反应①CO2+2NaOH=Na2CO3+H2O、②CO2+NaOH=NaHCO3进行,NaOH、CO2无剩余,恰好反应,溶液中溶质为Na2CO3、NaHCO3.
100mL2mol/L的NaOH溶液中n(NaOH)=0.1L×2mol/L=0.2mol,3.36LCO2气体的物质的量n(CO2)=
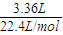 =0.15mol,
=0.15mol,n(NaOH):n(CO2)=0.2mol:0.15mol=1:0.75,故反应CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,NaOH、CO2无剩余,恰好反应,溶液中溶质为Na2CO3、NaHCO3.令溶液中Na2CO3、NaHCO3的物质的量分别为amol、bmol,根据钠元素守恒、碳元素守恒列方程计算a、b的值,再根据m=nM计算质量.
解答:解:100mL2mol/L的NaOH溶液中n(NaOH)=0.1L×2mol/L=0.2mol,3.36LCO2气体的物质的量n(CO2)=
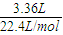 =0.15mol,n(NaOH):n(CO2)=0.2mol:0.15mol=1:0.75,故反应CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,NaOH、CO2无剩余,恰好反应,溶液中溶质为Na2CO3、NaHCO3.
=0.15mol,n(NaOH):n(CO2)=0.2mol:0.15mol=1:0.75,故反应CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,NaOH、CO2无剩余,恰好反应,溶液中溶质为Na2CO3、NaHCO3.令溶液中Na2CO3、NaHCO3的物质的量分别为amol、bmol,则:
根据钠元素守恒有2a+b=0.2
根据碳元素守恒有a+b=0.15
联立解得:a=0.05,b=0.1
所以反应后溶液中溶质的质量为0.05mol×106g/mol+0.1mol×84g/mol=13.7g
答:反应后溶液中溶质的质量为13.7g.
点评:本题考查根据方程式的计算,难度中等,判断发生的反应是解题的关键,可以利用过程法解答,但较麻烦.

练习册系列答案
相关题目