题目内容
将两种气态烃组成的混合气体0.1mol,完全燃烧后得到0.16mol二氧化碳和3.6克水, 则混合气体中 ( )
| A.混合气体中一定有甲烷 | B.混合气体中一定有甲烷和乙烯 |
| C.混合气体中一定有乙烷 | D.混合气体中一定有乙炔 |
A
试题分析:水的物质的量是3.6g÷18g/mol=0.2mol,所以根据原子守恒可知,该混合气体的平均分子式是C1.6H4。因此根据平均值原理可知,混合气中一定含有甲烷。又因为甲烷中含有4个氢原子,所以另外一种烃中氢原子数也一定是4个,而碳原子数则大于1,所以正确的答案选A。
点评:该题是中等难度的试题,试题综合性强,注重基础和能力的双向考查,有利于培养学生的逻辑思维能力和创新思维能力。该题的关键是得出混合气的平均分子式,然后借助于平均值原理,灵活运用即可。

练习册系列答案
相关题目
 B
B
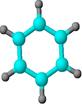
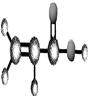
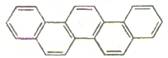
 )
) ),其余为氯原子。则氯原子的个数为 ( )
),其余为氯原子。则氯原子的个数为 ( )