题目内容
75 mL的CH4、H2和CO混合气体与200 mL O2混合点燃,经充分反应并干燥,体积减少100 mL,再将剩余气体通过碱液吸收,还有125 mL。上述体积均在298 K、1.01×105 Pa时测定。(1)判断混合气体是否能完全燃烧。
(2)总体积减少100 mL后,所得气体是什么?有多少毫升?
(3)共生成CO2多少毫升?最后剩余125 mL气体是什么?
(4)原混合气体中各有多少毫升?
解析:(1)采用极限法,判断O2是否过量。根据CH4+2O2;2H2+O2;2CO+O2可知即使75 mL气体都为CH4气体,O2都过剩,因而75 mL混合气体可完全燃烧。
(2)燃烧并干燥的气体是CO2和剩余的O2,体积为200 mL+75 mL-100 mL=175 mL。
(4)设原混合气体中含CH4、H2、CO体积各为x、y、z,则
CH4+2O2=CO2+2H2O
x 2x
2H2+O2=2H2O
y ![]()
2CO+O2=2CO2
z ![]()
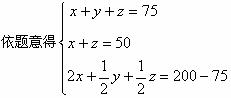
解之得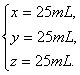
答案:(1)完全燃烧。(2)CO2和O2;175 mL。(3)CO2,50 mL;O2。(4)CH4,25 mL;H2,25 mL;CO,25 mL。

练习册系列答案
相关题目