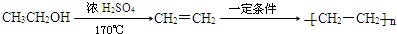题目内容
(1)相对分子质量为72的烷烃的分子式是
(2)标准状况下11.2L乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了5.6g.求原混合气体中乙烯与乙烷的物质的量之比和质量比.
C5H12
C5H12
,1mol该烷烃与氯气发生取代反应,当烷烃中的氢全部被取代后,消耗氯气的物质的量是12
12
mol.(2)标准状况下11.2L乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了5.6g.求原混合气体中乙烯与乙烷的物质的量之比和质量比.
分析:(1)根据烷烃的分子式为CxH(2x+2),相对分子质量为72,列出方程式进行计算x值;根据取代反应的本质可知当烷烃中的氢全部被取代后,消耗氯气的物质的量等于烷烃中氢原子的物质的量;
(2)根据乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g,即为乙烯的质量,再根据n=
=
,计算物质的量、质量关系;
(2)根据乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g,即为乙烯的质量,再根据n=
| m |
| M |
| V |
| Vm |
解答:解:(1)烷烃的分子式为CxH(2x+2),则14x+2=72,解得x=5,所以该烷烃的分子式为C5H12;烷烃中的氢全部被取代后,消耗氯气的物质的量等于烷烃中氢原子的物质的量,1mol该烷烃中含有12mol氢原子,则消耗氯气的物质的量是12mol;
故答案为:C5H12;12;
(2)11.2L混合气体的物质的量为n=
=
=0.5mol,乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g,即为乙烯的质量,所以乙烯的物质的量为n=
=0.2mol,则乙烷的物质的量为:0.5mol-0.2mol=0.3mol,质量为0.3mol×30g/mol=9g,所以,乙烯与乙烷的物质的量之比为0.2mol:0.3mol=2:3,质量之比为:5.6g:9g=28:45;
答:原气体混合物中乙烯与乙烷的物质的量之比为2:3,质量之比为:28:45;
故答案为:C5H12;12;
(2)11.2L混合气体的物质的量为n=
| V |
| Vm |
| 11.2L |
| 22.4L/mol |
| 5.6g |
| 28g/mol |
答:原气体混合物中乙烯与乙烷的物质的量之比为2:3,质量之比为:28:45;
点评:本题考查物质的量的相关计算,题目难度不大,注意烷烃中的氢全部被取代后,消耗氯气的物质的量等于烷烃中氢原子的物质的量,乙烯与乙烷的性质差别是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 名称是
名称是 名称为
名称为 )的官能团的名称:
)的官能团的名称: 图是一个正方体,设想将一个甲烷分子放入,碳原子将位于该正方体的中心,黑球表示已有一个氢原子属该正方体的一角.请在图中另画三个黑球表示其他3个氢原子的位置
图是一个正方体,设想将一个甲烷分子放入,碳原子将位于该正方体的中心,黑球表示已有一个氢原子属该正方体的一角.请在图中另画三个黑球表示其他3个氢原子的位置
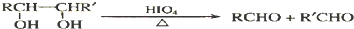
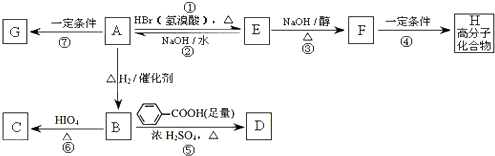

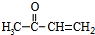
 合成OHC(CH2)2CHO(用反应流程图表示,注明反应物、反应条件;无机试剂可自选).反应流程图示例(由乙醇合成聚乙烯):
合成OHC(CH2)2CHO(用反应流程图表示,注明反应物、反应条件;无机试剂可自选).反应流程图示例(由乙醇合成聚乙烯):