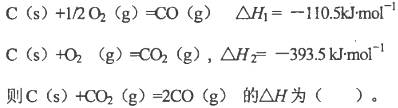题目内容
向足量H2SO4溶液中加入110 mL 0.4 mol/L Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入110 mL 0.4 mol/L HCl溶液时,放出的热量是2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
| A.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-0.72 kJ/mol |
| B.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-2.92 kJ/mol |
| C.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-16.4 kJ/mol |
| D.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-73.0 kJ/mol |
C
解析

近年来,全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是( )
| A.太阳能、地热能、生物质能和核聚变能均属于“新能源” |
| B.“低碳”是指采用含碳量低的烃类作为燃料 |
C.下图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想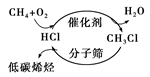 |
| D.让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用 |
下图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )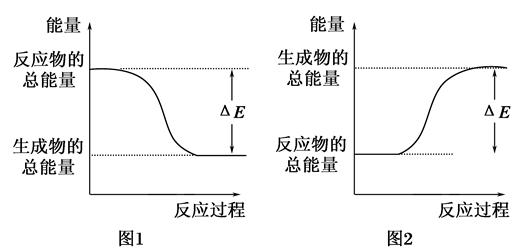
| A.500mL 2.0mol·L-1 HCl和500mL 2.0mol·L-1 NaOH的反应符合图1,且ΔE=57.3kJ |
| B.500mL 2.0mol·L-1 H2SO4和500mL 2.0mol·L-1 Ba(OH)2的反应符合图2,且ΔE=114.6kJ |
| C.发生图1能量变化的任何反应,一定不需加热即可发生 |
| D.CaO、浓硫酸溶于水时的能量变化符合图1 |
美国某技术公司开发出纳米级催化剂,可在较低温度下将甲烷转化成乙烯:2CH4(g)??C2H4(g)+2H2(g) ΔH,已知在降低温度时该反应平衡向左移动,且有下列两个反应(Q1、Q2均为正值):
反应Ⅰ:C(s)+2H2(g)=CH4(g) ΔH1=-Q1
反应Ⅱ:C(s)+H2(g)= C2H4(g) ΔH2=-Q2
C2H4(g) ΔH2=-Q2
则下列判断正确的是( )
| A.ΔH<0 | B.Q2>Q1 | C.ΔH=2(Q1-Q2) | D.ΔH=Q1-Q2 |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )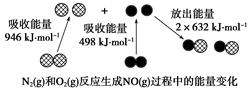
| A.1 mol N2(g)和NA个O2(g)反应放出的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
甲醛是一种重要的化工产品,可以利用甲醇脱氢制备,反应式如下:
①CH3OH(g) CH2O(g)+H2(g) ΔH1="+84.2" kJ·mol-1
CH2O(g)+H2(g) ΔH1="+84.2" kJ·mol-1
向反应体系中通入氧气,通过反应②2H2(g)+O2(g) 2H2O(g) ΔH2="-483.6" kJ·mol-1提供反应①所需热量,要使反应温度维持在700 ℃,则进料中甲醇与氧气的物质的量之比约为( )
2H2O(g) ΔH2="-483.6" kJ·mol-1提供反应①所需热量,要使反应温度维持在700 ℃,则进料中甲醇与氧气的物质的量之比约为( )
| A.5.74∶1 | B.11.48∶1 | C.1∶1 | D.2∶1 |
在25 ℃、101 kPa时,CH4(g)、H2(g)、C(s)的燃烧热分别是-890.3 kJ·mol-1、-285.8 kJ·mol-1和-393.5 kJ·mol-1,则CH4(g)―→C(s)+2H2(g)的ΔH是( )
| A.-74.8 kJ·mol-1 | B.+74.8 kJ·mol-1 |
| C.-211.0 kJ·mol-1 | D.+211.0 kJ·mol-1 |
 C(g)+D(g),过程中的能量变化如图所示,回答下列问题。
C(g)+D(g),过程中的能量变化如图所示,回答下列问题。