题目内容
前四周期原子序数依次增大的元素A,B,C,D中, A是电负性最大的元素,并且A-和B+的电子数相差为8;C和D原子序数相差为2,且都与B位于同一周期,C元素的次外层电子数是最外层电子数的7倍。

回答下列问题:
(1)D的价层电子排布式为_______。
(2)请用电子式表示A、B两元素形成化合物的过程。 。
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
①该化合物的化学式为_________;D的配位数为_______;
②列式计算该晶体的密度___ ____g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_ ____;该化合物中存在一个复杂离子,该离子的化学式为___ ____,配位数是_ __。
(1)3d84s2(该空1分,其余每空2分)
(2)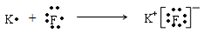
(3)①K2NiF4; 6
②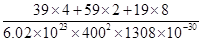 =3.4
=3.4
(4)离子键、配位键; [FeF6]3-; 6
【解析】
试题分析:(1)A是电负性最大的元素,所以A是F;A-和B+的电子数相差为8,所以B是K;C元素的次外层电子数是最外层电子数的7倍,因为铁的核外电子排布式为:1s22s22p63s23p63d64s2所以C是Fe;C和D原子序数相差为2,因此D是28号元素镍(Ni)。价层电子指与化合价有关的电子。对于过渡元素来讲指的是最外层电子跟内层的一部分电子,3d84s2
(2)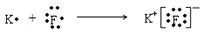
(3)A为棱上有16个,面心有4个,体心有2个,所以晶胞中含有A的个数为: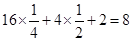 ;
;
B为棱上有8个,面心有2个,含有B的个数为: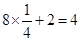 ;D为顶点上有8个,面心有1个,所以晶胞中含有D的个数为:
;D为顶点上有8个,面心有1个,所以晶胞中含有D的个数为: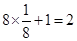 。因此①该化合物的化学式为:K2NiF4;根据晶胞的结构简式可知,中间的立方体中Ni原子周围最近的F原子个数是6,既配位数是6
。因此①该化合物的化学式为:K2NiF4;根据晶胞的结构简式可知,中间的立方体中Ni原子周围最近的F原子个数是6,既配位数是6
②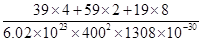 =3.4
=3.4
(4)钾离子与六氟合铁酸根离子之间形成离子键,氟元素与铁元素之间形成配位键; [FeF6]3-;6
考点:晶体的有关知识。

 已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍.D、E为同主族元素,且E的原子序数为D的2倍.F元素在地壳中含量位于金属元素的第二位.试回答下列问题:
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍.D、E为同主族元素,且E的原子序数为D的2倍.F元素在地壳中含量位于金属元素的第二位.试回答下列问题:

 (1)依据第2周期元素第一电离能的变化规律,参照如图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.
(1)依据第2周期元素第一电离能的变化规律,参照如图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.
 键;D.
键;D. 键;E.p—p
键;E.p—p 键;F.
键;F. 键;G.
键;G. 键;H.
键;H.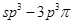 键
键