题目内容
关于0.2mol/L的NaOH溶液,下列说法不正确的是( )
| A、100mL该溶液中含0.8g NaOH |
| B、200mL该溶液与100mL 0.2mol/L的硫酸溶液反应形成中性溶液 |
| C、100mL该溶液中约含0.02mol×6.02×1023mol-1个Na+ |
| D、配制含1L水的该溶液,需NaOH的质量为8g |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:A.根据n=cV计算NaOH物质的量,再根据m=nM计算其质量;
B.根据n=cV计算NaOH、硫酸的物质的量,结合方程式2NaOH+H2SO4=Na2SO4+2H2O判断;
C.根据n=cV计算Na+物质的量,再根据N=nNA计算;
D.1L 0.2mol/L的NaOH溶液需要NaOH为8g,溶液体积为1L,不是溶剂水的体积.
B.根据n=cV计算NaOH、硫酸的物质的量,结合方程式2NaOH+H2SO4=Na2SO4+2H2O判断;
C.根据n=cV计算Na+物质的量,再根据N=nNA计算;
D.1L 0.2mol/L的NaOH溶液需要NaOH为8g,溶液体积为1L,不是溶剂水的体积.
解答:
解:A.NaOH物质的量=0.1L×0.2mol/L=0.02mol,其质量=0.02mol×40g/mol=0.8g,故A正确;
B.NaOH物质的量=0.2L×0.2mol/L=0.04mol,硫酸的物质的量=0.1L×0.2mol/L=0.02mol,由方程式2NaOH+H2SO4=Na2SO4+2H2O,可知二者恰好反应,所得溶液为硫酸钠溶液,溶液呈中性,故B正确;
C.Na+物质的量=0.1L×0.2mol/L=0.02mol,约含0.02mol×6.02×1023mol-1个Na+,故C正确;
D.1L 0.2mol/L的NaOH溶液需要NaOH为8g,溶液体积为1L,不是溶剂水的体积,故D错误,
故选D.
B.NaOH物质的量=0.2L×0.2mol/L=0.04mol,硫酸的物质的量=0.1L×0.2mol/L=0.02mol,由方程式2NaOH+H2SO4=Na2SO4+2H2O,可知二者恰好反应,所得溶液为硫酸钠溶液,溶液呈中性,故B正确;
C.Na+物质的量=0.1L×0.2mol/L=0.02mol,约含0.02mol×6.02×1023mol-1个Na+,故C正确;
D.1L 0.2mol/L的NaOH溶液需要NaOH为8g,溶液体积为1L,不是溶剂水的体积,故D错误,
故选D.
点评:本题考查物质的量浓度,比较基础,注意对概念的理解与公式的灵活应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
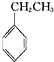
下列有机物中,既能发生消去反应,又能发生取代反应和酯化反应的是( )
A、 |
| B、CH3CH2CH2CH2Cl |
| C、HO-CH2-CH2-COOH |
| D、Cl-CH2-COOH |
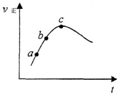 向绝热恒容密闭容器中通入气体A和B,一定条件下:A(g)+B(g)?C(g)+D(g)△H=QkJ/mol达到平衡,其正反应速率随时间变化的示意图如图所示.下列说法正确的是( )
向绝热恒容密闭容器中通入气体A和B,一定条件下:A(g)+B(g)?C(g)+D(g)△H=QkJ/mol达到平衡,其正反应速率随时间变化的示意图如图所示.下列说法正确的是( )| A、反应体系中加入催化剂,反应速率增大,△H也增大 |
| B、反应物的浓度:a点小于b点 |
| C、反应在C点达到到平衡 |
| D、达到平衡后,想办法升温,A的转化率将减小 |
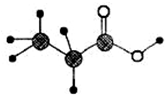 如图是某种有机物的简易球棍模型,该有机物中只含有C、H、O三种元素,下列关于该有机物的说法中不正确的是( )
如图是某种有机物的简易球棍模型,该有机物中只含有C、H、O三种元素,下列关于该有机物的说法中不正确的是( )| A、分子式是C3H6O2 |
| B、不能与碳酸钠溶液反应 |
| C、能使紫色石蕊溶液变红 |
| D、能发生酯化反应 |
在下面哪些反应中浓硫酸既表现出强氧化性又表现出酸性( )
A、2NaCl+H2SO4(浓)
| ||||
B、Na2SO3+H2SO4(浓)
| ||||
C、C+2H2SO4(浓)
| ||||
D、Cu+2H2SO4(浓)
|
 近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是( )
近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是( )| A、苹果酸在一定条件下能发生消去反应 |
| B、1mol苹果酸与Na2CO3溶液反应必须消耗2mol Na2CO3 |
| C、苹果酸在一定条件下能发生酯化反应 |
| D、苹果酸在一定条件下能发生催化氧化反应 |
 B.
B. C.
C.
 E.
E. F.2-甲基丁烷和2,2-二甲基丙烷
F.2-甲基丁烷和2,2-二甲基丙烷
 (g)+CO2(g)?
(g)+CO2(g)? (g)+CO(g)+H2O(g)△H=-166kJ?mol-1
(g)+CO(g)+H2O(g)△H=-166kJ?mol-1