题目内容
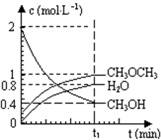
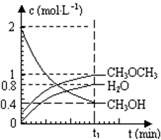 已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ?mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题:
已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ?mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题:(1)该条件下反应平衡常数表达式K=
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
5
5
,达到平衡时n(CH3OH):n(CH3OCH3):n(H2O)=2:5:4
2:5:4
.(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4mol?L-1、c(H2O)=0.6mol?L-1、c(CH3OCH3)=1.2mol?L-1,此时正、逆反应速率的大小:v (正)
>
>
v (逆)(填“>”、“<”或“=”),反应向正反应方向
正反应方向
进行(填“正反应方向”或“逆反应方向”).分析:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写平衡常数表达式;
由图可知,在t1min时到达平衡,平衡时CH3OH、CH3OCH3、H2O浓度分别为0.4mol/L、1mol/L、0.8mol/L,代入平衡常数表达式计算;
体积相同,物质的量之比等于浓度之比,据此计算达到平衡时n(CH3OH):n(CH3OCH3):n(H2O);
(2)计算常数的浓度商Qc,与平衡常数比较,判断反应进行的方向,进而判断正、逆反应速率关系.
由图可知,在t1min时到达平衡,平衡时CH3OH、CH3OCH3、H2O浓度分别为0.4mol/L、1mol/L、0.8mol/L,代入平衡常数表达式计算;
体积相同,物质的量之比等于浓度之比,据此计算达到平衡时n(CH3OH):n(CH3OCH3):n(H2O);
(2)计算常数的浓度商Qc,与平衡常数比较,判断反应进行的方向,进而判断正、逆反应速率关系.
解答:解:(1)对于可逆反应2CH3OH(g)?CH3OCH3(g)+H2O(g)的平衡常数k=
,
由图可知,在t1min时到达平衡,平衡时CH3OH、CH3OCH3、H2O浓度分别为0.4mol/L、1mol/L、0.8mol/L,故平衡常数k=
=
=5,
体积相同,物质的量之比等于浓度之比,故n(CH3OH):n(CH3OCH3):n(H2O)=0.4mol/L:1mol/L:0.8mol/L=2:5:4,
故答案为:
,5,2:5:4;
(2)此时的浓度商Qc=
=4.5,小于平衡常数5,故反应向正反应进行,v (正)>v (逆),
故答案为:>,正反应方向.
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
由图可知,在t1min时到达平衡,平衡时CH3OH、CH3OCH3、H2O浓度分别为0.4mol/L、1mol/L、0.8mol/L,故平衡常数k=
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| 1×0.8 |
| 0.42 |
体积相同,物质的量之比等于浓度之比,故n(CH3OH):n(CH3OCH3):n(H2O)=0.4mol/L:1mol/L:0.8mol/L=2:5:4,
故答案为:
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
(2)此时的浓度商Qc=
| 0.6×1.2 |
| 0.42 |
故答案为:>,正反应方向.
点评:考查化学平衡常数的有关计算与应用、化学平衡图象等,难度中等,注意掌握化学平衡常数的应用:1、用来判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、用来计算物质的转化率.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
 (2012?虹口区二模)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)?CH3OCH3(g)+3H2O(g)
(2012?虹口区二模)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)?CH3OCH3(g)+3H2O(g)