题目内容
【题目】氧化铬(Cr2O3)主要用于冶炼金属铬、有机化学合成的催化剂等。工业上是以铬铁矿[主要成份为Fe(CrO2)2,还含有Al2O3、SiO2等杂质]为主要原料进行生产,其主要工艺流程如下:
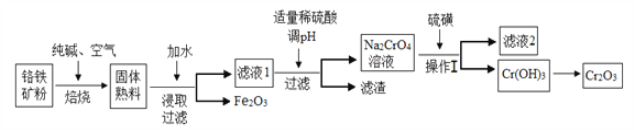
(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)焙烧时的主要反应为:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,该步骤不能使用陶瓷容器,原因是____________________________________。
8Na2CrO4+2Fe2O3+8CO2,该步骤不能使用陶瓷容器,原因是____________________________________。
(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:___________________________。
(4)硫磺在与铬酸钠的反应中转化为硫代硫酸钠,反应的离子方程式为________________________。滤渣中除Al(OH)3外还有__________(填化学式)。
(5)某工厂用448 kg铬铁矿粉[含Fe(CrO2)280%]制备Cr2O3,最终得到产品182.4 kg,产率为______%。
(6)Cr3+也有一定毒性,会污染水体,常温下要除去废液中多余的Cr3+,调节pH至少为_______,才能使铬离子沉淀完全。(已知溶液中离子浓度小于1×10-5 mol·L-1,则认为离子完全沉淀;Cr(OH)3的溶度积常数为1.0×10-32。)
【答案】 +3 陶瓷在高温下会与Na2CO3反应 将蒸馏水沿着玻璃棒慢慢倒入漏斗中浸没沉淀,待水流尽后,再重复操作2~3次 4CrO42+6S+7H2O=4Cr(OH)3↓+3S2O32+2OH H2SiO3 75.0 5.0
【解析】(1)根据元素化合价代数和为零的原则计算;(2)陶瓷的成分之一高温下能够与碳酸钠反应;(3)掌握如何过滤、洗涤等操作的步骤;(4)在硫磺与铬酸钠的反应中生成物是硫代硫酸钠,根据离子反应的特点和离子方程式书写要求写出离子反应方程式;(5)根据Cr元素守恒计算理论上生成的Cr2O3的质量,确定产率;(6)根据溶度积常数进行计算。
(1)亚铬酸亚铁[Fe(CrO2)2]中Fe元素化合价是+2价,O元素化合价-2价,根据化合价代数和为零的原则进行计算,Cr的化合价是+3价,正确答案:+3价;
(2)陶瓷的主要成分是硅酸盐,其成分中的SiO2与Na2CO3在高温下能够发生反应,SiO2+Na2CO3![]() Na2SiO3+CO2↑,所以在焙烧时不能使用陶瓷容器,正确答案:陶瓷在高温下会与Na2CO3反应;
Na2SiO3+CO2↑,所以在焙烧时不能使用陶瓷容器,正确答案:陶瓷在高温下会与Na2CO3反应;
(3)洗涤沉淀的操作是:将蒸馏水沿着玻璃棒慢慢倒入漏斗中浸没沉淀,待水流尽后,再重复操作2~3次,正确答案:将蒸馏水沿着玻璃棒慢慢倒入漏斗中浸没沉淀,待水流尽后,再重复操作2~3次;
(4)硫磺与铬酸钠的反应生成硫代硫酸钠,同时生成氢氧化钠和氢氧化铬沉淀,反应的离子方程式:4CrO42+6S+7H2O=4Cr(OH)3↓+3S2O32+2OH;在焙烧时Al2O3和SiO2分别与碳酸钠在高温下生成NaAlO2和Na2SiO3,NaAlO2和Na2SiO3在酸性条件下生成Al(OH)3和H2SiO3沉淀,所以滤渣中除Al(OH)3外还有H2SiO3沉淀,正确答案:4CrO42+6S+7H2O=4Cr(OH)3↓+3S2O32+2OH;H2SiO3;
(5)铬铁矿粉中含Fe(CrO2)2的质量:m[Fe(CrO2)2]=448Kg×80%=358.4Kg,根据Cr元素守恒,理论上得到的Cr2O3:n(Cr2O3)=358.4Kg×103÷224g/mol=1.6×103mol;m(Cr2O3)=1.6×103mol×152g/mol=2.432×105g=243.2Kg,所以生成Cr2O3的产率:182.4 kg/ 243.2Kg×100%=75%,正确答案:75%;
(6)Ksp[Cr(OH)3]=C(Cr3+)×C3(OH-),1.0×10-32 =1×10-5 mol·L-1×C3(OH-)
C(OH-)=1.0×10-9 mol·L-1,POH=9.0,PH=5.0,因此常温下要除去废液中多余的Cr3+,使铬离子沉淀完全,调节pH至少为5.0,正确答案:5.0。