题目内容
19.某矿石主要含Al2O3、Fe2O3、FeO及少量钙镁的化合物.某实验小组利用该矿石制得较纯净Al(OH)3的过程如下.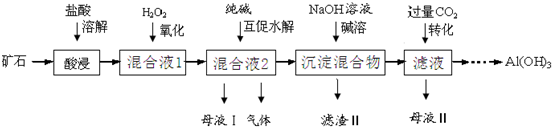
(1)“氧化”的目的是将Fe2+氧化成Fe3+,有利于其水解除去铁元素;“氧化”时发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)检验“水解”得到的母液Ⅰ中已不存在Fe3+的方法是取少量母液Ⅰ,滴加KSCN溶液,无血红色,则母液Ⅰ中已不存在Fe3+.
(3)过滤得到的滤渣Ⅱ必须用蒸馏水洗涤,洗涤液要并入“碱溶”后得到的溶液,该操作的目的是减小铝元素损失,提高Al(OH)3产率;
(4)第四步中用NaOH溶液溶解部分沉淀混合物的离子方程式为Al(OH)3+OH-=AlO2-+2H2O
(5)如开始所取矿石质量为5g,最后得到的Al(OH)3的质量为3.9g,则矿石样品中Al2O3的质量分数为51%.
分析 矿石溶于稀盐酸发生的反应有Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O、FeO+2H+=Fe2++H2O,向滤液中加入过氧化氢氧化亚铁离子,发生的反应为2Fe2++H2O2+2H+=2H2O+2Fe3+,向溶液中加入碳酸钠,发生的反应为3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑、CO32-+Ca2+=CaCO3↓、Mg2++2H2O?Mg(OH)2+2H+、Fe3++3H2O?Fe(OH)3+3H+,过滤得到的滤液中含有NaCl,向滤渣中加入过量NaOH溶液,Al(OH)3溶解,其余沉淀不溶解,过滤后得到的滤渣II为CaCO3、Mg(OH)2和Fe(OH)3,滤液中含有NaAlO2,向滤液中通入二氧化碳,发生的反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-),然后过滤得到Al(OH)3,母液II中含有NaHCO3或碳酸钠,据此分析解答,
(1)“氧化”的目的是利用过氧化氢的氧化性氧化亚铁离子为铁离子;
(2)检验“水解”得到的母液Ⅰ中已不存在Fe3+的方法是取少量母液Ⅰ,滴加KSCN溶液检验铁离子的存在;
(3)过滤得到的滤渣Ⅱ必须用蒸馏水洗涤,洗涤液要并入“碱溶”后得到的溶液,减少铝元素损耗;
(4)氢氧化铝具有两性,和氢氧化钠溶液发生反应,生成偏铝酸钠溶液;
(5)依据铝元素守恒计算,氢氧化铝物质的量得到氧化铝物质的量,2Al(OH)3~Al2O3,据此计算质量分数.
解答 解:矿石溶于稀盐酸发生的反应有Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O、FeO+2H+=Fe2++H2O,向滤液中加入过氧化氢氧化亚铁离子,发生的反应为2Fe2++H2O2+2H+=2H2O+2Fe3+,向溶液中加入碳酸钠,发生的反应为3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑、CO32-+Ca2+=CaCO3↓、Mg2++2H2O?Mg(OH)2+2H+、Fe3++3H2O?Fe(OH)3+3H+,过滤得到的滤液中含有NaCl,向滤渣中加入过量NaOH溶液,Al(OH)3溶解,其余沉淀不溶解,过滤后得到的滤渣II为CaCO3、Mg(OH)2和Fe(OH)3,滤液中含有NaAlO2,向滤液中通入二氧化碳,发生的反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-),然后过滤得到Al(OH)3,母液II中含有NaHCO3或碳酸钠.
(1)“氧化”的目的是利用过氧化氢的氧化性氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,通过调节溶液PH促进铁离子水解便于除去铁离子,
故答案为:将Fe2+氧化成Fe3+,有利于其水解除去铁元素;2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)检验“水解”得到的母液Ⅰ中已不存在Fe3+的方法是取少量母液Ⅰ,滴加KSCN溶液,无血红色,则母液Ⅰ中已不存在Fe3+,
故答案为:取少量母液Ⅰ,滴加KSCN溶液,无血红色,则母液Ⅰ中已不存在Fe3+;
(3)过滤得到的滤渣Ⅱ必须用蒸馏水洗涤,洗涤液要并入“碱溶”后得到的溶液,操作的目的是减小铝元素损失,提高Al(OH)3产率,
故答案为:减小铝元素损失,提高Al(OH)3产率;
(4)第四步中用NaOH溶液溶解部分沉淀混合物是利用氢氧化铝具有两性,和氢氧化钠溶液发生反应,生成偏铝酸钠溶液,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(5)如开始所取矿石质量为5g,最后得到的Al(OH)3的质量为3.9g,由铝元素守恒可知矿石样品中Al2O3的质量分数=$\frac{\frac{3.9g}{78g/mol}×\frac{1}{2}×102g/mol}{5.0g/mol}$×100%=51%,
故答案为:51%.
点评 本题考查制备实验方案设计,为高考高频点,此种题型涉及物质性质、实验基本操作,明确物质的性质及每一步发生的反应、基本操作方法是解本题关键,熟练掌握元素化合物知识,灵活运用知识解答问题,题目难度中等.

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 1 mol Cl2与足量的铁反应,转移的电子数为3NA | |
| C. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA | |
| D. | 1 L 0.1 mol•L-1 NaHCO3溶液中含有0.1 NA个HCO3- |
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×l0-10 |
| CH3COOH | K=1.8×l0-5 |
| H2CO3 | K1=4.3×l0-7、K2=5.6×l0-11 |
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,混合后溶液显碱性,则混合液中各离子浓度的大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+)[用“>”和c(A+)、c(B-)表示].
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3.
| A. | CO2的电子式 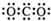 | B. | N2的电子式  | ||
| C. | 乙烯的结构简式 C2H4 | D. | -OH的电子式 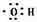 |
| A. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| B. | 还原性强弱:F-<Cl-<Br-<I- | |
| C. | 核外电子排布相同的微粒化学性质一定相同 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| A. | 氯化铵晶体和碘晶体加热都产生气体 | |
| B. | KMnO4、二氧化锰分别与浓盐酸混合(可加热),都产生黄绿色气体 | |
| C. | 常温下铁和铂都不溶于浓硝酸 | |
| D. | SO2通入BaCl2溶液至饱和,再加入硝酸或苛性钠溶液,都能产生白色沉淀 |
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应.(填“吸热”或“放热”)
(3)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.02mol/L,则反应开始时,H2O的消耗速率比生成速率大(填“大”“小”或“不能确定”)
(4)830℃,在1L的固定容器的密闭容器中放入3molCO2和1molH2,平衡后CO2的转化率为25%,
H2的物质的量为0.25mol.
| A. | HCl是氧化剂 | B. | 参加反应的HCl部分被氧化 | ||
| C. | HCl被还原 | D. | 参加反应的HCl全部被氧化 |