题目内容
下列叙述不正确的是( )
A.“海沙危楼”是由于海沙带有腐蚀性,会腐蚀混凝土中的钢筋等
B.食用地沟油对人体危害极大,是因为含有黄曲霉素等有毒物质
C.开发利用太阳能、风能、生物能、海洋能等清洁能源,符合“低碳经济”
D.光化学烟雾、温室效应、硝酸型酸雨的形成都只与氮氧化物有关
D
【解析】海沙含盐,会使混凝土中的钢筋受到腐蚀,A项正确;地沟油含有多种有毒物质,食用对人体危害极大,B项正确;利用太阳能、风能等可减少CO2的排放,符合“低碳经济”,C项正确;温室效应与CO2有关,D项错误。

 阅读快车系列答案
阅读快车系列答案某无色溶液中只可能含有①Na+、②Ba2+、③Cl-、④I-、⑤S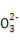 、⑥S
、⑥S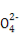 离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到现象如下表。下列结论正确的是( )
离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到现象如下表。下列结论正确的是( )
步骤 | 操作 | 现象 |
① | 用pH试纸检验 | 溶液的pH大于7 |
② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈紫红色 |
③ | 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
A.肯定含有的离子是③④⑤
B.肯定没有的离子是②⑤
C.不能确定的离子是③⑥
D.可能含有的离子是①⑥
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下表(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大:
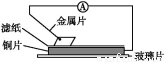
金属 | 电子流动方向 | 电压/V |
甲 | 甲→Cu | +0.78 |
乙 | Cu→乙 | -0.25 |
丙 | 丙→Cu | +1.35 |
丁 | 丁→Cu | +0.30 |
依据记录数据判断,下列结论中正确的是( )
A.将甲、乙形成的合金露置在空气中,甲先被腐蚀
B.金属乙能从硫酸铜溶液中置换出铜
C.在四种金属中丙的还原性最弱
D.甲、丁若形成原电池时,甲为正极
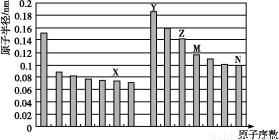
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
X | 578 | 1 817 | 2 745 | 11 578 |
Y | 738 | 1 451 | 7 733 | 10 540 |
Z | 496 | 4 562 | 6 912 | 9 543 |
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能的原因是
。
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C三原子都采取sp3杂化。
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示)。
②M是含有 键的 分子(填“极性”或“非极性”)。
③N是一种易液化的气体,请简述其易液化的原因:
。
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 。
⑤AB-中和B2分子的π键数目比为 。
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1。
①E元素组成的单质的晶体堆积模型为 (填字母)。
a.简单立方堆积b.体心立方堆积
c.六方最密堆积d.面心立方最密堆积
②F元素在其化合物中最高化合价为 。
③G2+的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 。