题目内容
煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧,造成环境污染的主要原因之一是形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式______________________________________。
②以下是对硝酸型酸雨的评价,其中正确的是________(用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统;
b.对电线、铁轨、桥梁、房屋等均会造成严重损害;
c.破坏臭氧层;
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥。
(2)下图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式____________________________。
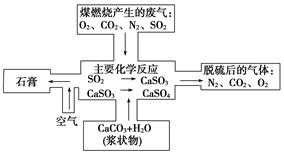
(3)脱硫以后,在废气中含量明显增加的不良气体是(写物质名称)________,它对环境的负面影响是______________________________________________________________________。
(4)检验脱硫后废气中是否含有SO2的简单方法是__________________________________。
(1)①2NO+O2===2NO2,3NO2+H2O===2HNO3+NO ②abd
(2)CaCO3+SO2===CaSO3+CO2,2CaSO3+O2===2CaSO4,CaSO4+2H2O===CaSO4·2H2O
(3)二氧化碳 使“温室效应”加剧,导致全球气候变暖
(4)将气体通入品红溶液观察品红是否褪色,品红褪色,说明废气中还含有SO2;品红不褪色,说明废气中不含SO2
【解析】
试题分析:(1)①煤在燃烧过程中,会产生NO气体,而NO极易被氧化生成NO2,NO2溶于水即生成硝酸,从而形成硝酸型酸雨。有关反应的化学方程式是2NO+O2===2NO2、3NO2+H2O===2HNO3+NO。
②硝酸型酸雨和臭氧层破坏无关系,选项c不正确,其余硝酸都是正确的,答案选abd。
(2)SO2是酸性氧化物,能和碳酸钙反应,生成亚硫酸钙,亚硫酸钙不稳定,易被氧化氧化生成硫酸钙,硫酸钙结合水生成石膏,有关反应的化学方程式是CaCO3+SO2===CaSO3+CO2、2CaSO3+O2===2CaSO4、CaSO4+2H2O===CaSO4·2H2O。
(3)根据(2)中反应的方程式可知,在脱硫的过程中会产生大量的CO2气体,使“温室效应”加剧,导致全球气候变暖。
(4)SO2能使品红溶液褪色,所以检验SO2的简单方法是将气体通入品红溶液观察品红是否褪色,品红褪色,说明废气中还含有SO2;品红不褪色,说明废气中不含SO2。
考点:考查硝酸型酸雨的产生、危害;酸雨的防治、SO2气体的检验
点评:该题是高考中的常见题型,试题综合性强,贴近高考。该题突出化学与可持续发展、环境保护的密切联系,综合考查学生分析问题、解决问题的能力。有利于培养学生的环境保护意识,也有利于培养学生的规范答题能力。
