题目内容
(8分) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)  2SO3(g) △H=-190 kJ·mo1-1
2SO3(g) △H=-190 kJ·mo1-1
(1)在一固定容器中充入2mol SO2和1molO2 ,在一定的条件下达到平衡,反应放出的热量__________(填大于、小于或等于) 190 kJ
(2)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=______mol·L-1·min-1
(3)下列条件的改变对其反应速率几乎无影响的是 (选填序号)
①升高温度 ②保持体积不变,只增加氧气的质量 ③保持体积不变,充入Ne使体系压强增大 ④保持压强不变,充入Ne使容器的体积增大
(4)下列描述中能说明上述(1)反应已达平衡的是 (选填序号)
①v(O2)正=2v(SO3)逆 ②SO2、O2 、SO3的浓度之比为2:1:2
③单位时间内生成2n molSO2的同时生成2n mol SO3
④容器中气体的平均分子量不随时间而变化
⑤容器中气体的密度不随时间而变化 ⑥容器中气体压强不随时间而变化
(1) < (2) 0。036 (3) ③ (4) ③④⑥
【解析】(1)因为是可逆反应,所以2mol SO2和1molO2反应不可能生成2molSO3,即实际放出的热量要小于190 kJ。
(2)半分钟内生成0.18mol
SO3,则消耗氧气0.09mol,所以v(O2)=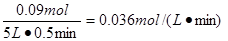 。
。
(3)升高温度,加快反应速率。增加氧气的浓度,加快反应速率。保持体积不变,充入Ne使体系压强增大,但物质的浓度并没有发生变化,所以反应速率不变。保持压强不变,充入Ne使容器的体积增大,则降低物质的浓度,所以反应速率降低。
(4)①中反应速率的方向相反,但没有满足相应的化学计量数之比,不能说明。②不能说明正逆反应速率是否相等,也不能说明。③中反应速率的方向相反,且满足相应的化学计量数之比,可以说明。平均分子量是气体的质量和气体的物质的量的比值,在反应过程中质量不变,但物质的量是变化的,所以当容器中气体的平均分子量不随时间而变化时,可以说明。密度是气体的质量和容器体积的比值,在反应过程中,二者均是不变的,即密度始终是不变的,不能说明。由于反应前后气体的体积是变化的,即压强是变化的,所以当容器中气体压强不随时间而变化时可以说明。

 2SO3(g) △H=-190 kJ·mo1-1
2SO3(g) △H=-190 kJ·mo1-1 2SO3(g) △H=-190 kJ·mo1-1
2SO3(g) △H=-190 kJ·mo1-1