题目内容
9. 电化学在生产、生活中具有广泛的应用.
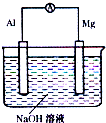
电化学在生产、生活中具有广泛的应用.(1)如图是某同学设计的原电池装置,当该电池放电时,Mg电极是电池的正极,写出Al的电极反应式Al+4OH--3e-=AlO2-+2H2O.
(2)粗铜中含有少量锌、铁、银、金等金属和少量不溶于酸的杂质,某化学实验小组以CuSO4溶液为电解质溶液,用电解方法实现粗铜的提纯,并对阳极泥和电解液中金属进行回收.
①电解精制:粗铜应做阳极,电解过程中CuSO4溶液的浓度变小(填“变大”、“不变”或“变小”).
②阳极泥处理及电解液中金属回收:
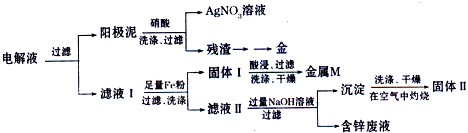
写出银与稀硝酸反应的离子方程式3Ag+4H++NO3-=3Ag++NO↑+2H2O.
③取滤液I 100mL,经过上述操作后得到3.2g金属M和4.8g固体Ⅱ,则滤液I中Fe2+的物质的量浓度为0.1mol/L.
分析 (1)Al、Mg、NaOH溶液构成的原电池中,Al为负极,Mg为正极,负极上Al失去电子,以此来解答;
(2)①电解方法精炼粗铜,粗铜做阳极,精铜做阴极,结合电极反应判断;
②金属银可以和硝酸反应得到硝酸银以及水和一氧化氮;
③根据流程滤液I主要为含二价铁离子和二价铜离子的溶液,经过加铁处理后置换出3.2g金属M为铜,最终得到4.8g固体Ⅱ为氧化铁,据此计算.
解答 解:(1)Al、Mg、NaOH溶液可构成原电池,Al为负极,Mg为正极,负极上Al失去电子,反应为Al+4OH--3e-=AlO2-+2H2O,故答案为:正;Al+4OH--3e-=AlO2-+2H2O;
(2))①电解方法精炼粗铜,电解池的阴极材料是纯铜,阳极为粗铜,先是锌、铁失电子生成离子,而阴极是溶液中的铜离子得电子析出铜单质,则硫酸铜溶液的浓度变小,故答案为:阳;变小;
②金属银可以和稀硝酸反应生成硝酸银、一氧化氮和水,即3Ag+4H++NO3-=3Ag++NO↑+2H2O,故答案为:3Ag+4H++NO3-=3Ag++NO↑+2H2O;
③根据流程滤液I主要为含二价铁离子和二价铜离子的溶液,根据流程最终得到4.8g固体Ⅱ为氧化铁即$\frac{4.8}{160}$=0.03mol,根据铁守恒所以最终溶液中含铁为0.03×2=0.06mol,又加铁处理后置换出3.2g金属M为铜即$\frac{3.2}{64}$=0.05mol,所以引入铁也为0.05mol,则原滤液I中含二价铁为0.06-0.05=0.01mol,所以滤液I中Fe2+的物质的量浓度为$\frac{0.01}{0.1}$=0.1mol/L,故答案为:0.1mol/L.
点评 本题涉及有关原电池的原理以及电解精炼铜、金属银的化学性质等综合知识,难度不大,抓住电化学的原理分析是解题关键.

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案| A. | 元素X的原子核内质子数可能为(2a2-1) | |
| B. | 元素X形成的单质既能作氧化剂又能作还原剂 | |
| C. | 元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数) | |
| D. | 由元素X形成的某些化合物,可能具有杀菌消毒的作用 |
| A. | 含有氢离子的溶液 | B. | 使酚酞显无色的溶液 | ||
| C. | pH<7的溶液 | D. | c(H+)>c(OH-)的溶液 |
| A. | 乙酸乙酯的结构简式:CH3CH2COOCH2CH3 | |
| B. | 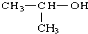 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | |
| C. | 聚丙烯的结构简式为: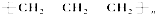 | |
| D. | CH4Si的结构式: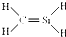 |
| A. | CO和H2O | B. | CO和H2 | C. | CO2和H2O | D. | CO2和H2 |
| A. | 水溶性 | B. | 热稳定性 | C. | 与酸反应 | D. | 焰色反应 |
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式
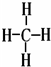 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式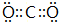 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式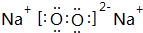 ;
;(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期第ⅥA族,请画出它的阴离子结构示意图
 ,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+
,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)写出④的最高价氧化物的水化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式3H++Al(OH)3=Al3++3H2O;OH-+Al(OH)3=AlO2-+2H2O.
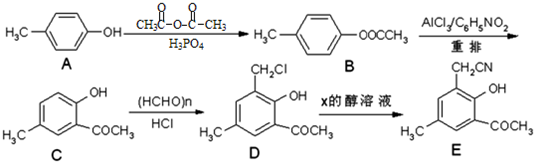
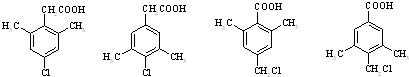 任意一种(任写一种).
任意一种(任写一种).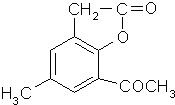 .
.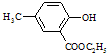 的合成路线流程图.
的合成路线流程图.