题目内容
已知室温时,0.01mo1?L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )A.加水稀释,溶液的pH增大
B.该溶液由水电离出的c(H+)为10-9mo1?L-1
C.该溶液的pH=4
D.HA与NaOH等物质的量反应的溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
【答案】分析:A、氢离子的浓度越小,pH越大;
B、酸电离生成的氢离子为0.01mo1/L×0.1%,根据水的离子积极水电离生成的c(OH-)=c(H+)来分析;
C、根据酸电离生成的氢离子的浓度,利用pH=-lgc(H+)来计算;
D、HA为弱酸,则HA与NaOH等物质的量反应生成NaA,利用强碱弱酸盐的水解来分析.
解答:解:A、加水稀释,促进弱酸的电离,但氢离子的浓度变小,则溶液的pH增大,故A正确;
B、酸电离生成的氢离子为0.01mo1/L×0.1%=10-5mo1?L-1,室温下Kw=1×10-14,则由水电离出的c(H+)为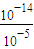 =10-9mo1?L-1,故B正确;
=10-9mo1?L-1,故B正确;
C、酸电离生成的氢离子为0.01mo1/L×0.1%=10-5mo1?L-1,则pH=-lgc(H+)=5,故C错误;
D、HA为弱酸,则HA与NaOH等物质的量反应生成NaA,A-水解,则c(Na+)>c(A-),水解显碱性,则c(OH-)>c(H+),又水解的程度很弱,则c(Na+)>c(A-)>c(OH-)>c(H+),故D正确;
故选C.
点评:本题考查弱电解质的电离及pH的计算、溶液中离子浓度的比较,明确弱酸中的氢离子的浓度、盐中有弱才水解的规律是解答本题的关键,并注意利用室温下水的离子积来计算.
B、酸电离生成的氢离子为0.01mo1/L×0.1%,根据水的离子积极水电离生成的c(OH-)=c(H+)来分析;
C、根据酸电离生成的氢离子的浓度,利用pH=-lgc(H+)来计算;
D、HA为弱酸,则HA与NaOH等物质的量反应生成NaA,利用强碱弱酸盐的水解来分析.
解答:解:A、加水稀释,促进弱酸的电离,但氢离子的浓度变小,则溶液的pH增大,故A正确;
B、酸电离生成的氢离子为0.01mo1/L×0.1%=10-5mo1?L-1,室温下Kw=1×10-14,则由水电离出的c(H+)为
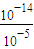 =10-9mo1?L-1,故B正确;
=10-9mo1?L-1,故B正确;C、酸电离生成的氢离子为0.01mo1/L×0.1%=10-5mo1?L-1,则pH=-lgc(H+)=5,故C错误;
D、HA为弱酸,则HA与NaOH等物质的量反应生成NaA,A-水解,则c(Na+)>c(A-),水解显碱性,则c(OH-)>c(H+),又水解的程度很弱,则c(Na+)>c(A-)>c(OH-)>c(H+),故D正确;
故选C.
点评:本题考查弱电解质的电离及pH的计算、溶液中离子浓度的比较,明确弱酸中的氢离子的浓度、盐中有弱才水解的规律是解答本题的关键,并注意利用室温下水的离子积来计算.

练习册系列答案
相关题目