题目内容
同学甲对某基态原子的价电子排布式书写为nS2nP P
P P
P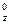 ,你认为同学甲所书写的电子排布式违背了下列选项中的
,你认为同学甲所书写的电子排布式违背了下列选项中的
 P
P P
P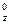 ,你认为同学甲所书写的电子排布式违背了下列选项中的
,你认为同学甲所书写的电子排布式违背了下列选项中的| A.能量最低原理 | B.泡利不相容原理 |
| C.洪特规则 | D.洪特的全充满、半充满、全空状态 |
C
略

练习册系列答案
相关题目
题目内容
 P
P P
P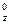 ,你认为同学甲所书写的电子排布式违背了下列选项中的
,你认为同学甲所书写的电子排布式违背了下列选项中的| A.能量最低原理 | B.泡利不相容原理 |
| C.洪特规则 | D.洪特的全充满、半充满、全空状态 |
