题目内容
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3·H2O |
| B | Mg2+、HCO3-、Cl- | 过量NaOH溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3·H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
B
解析

练习册系列答案
相关题目
下列反应的离子方程式书写不正确的是
| A.小苏打溶液显碱性:HCO3-+H2O≒H2CO3+OH- |
| B.FeCl3溶液中滴加过量的氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ |
| C.CuSO4溶液中滴加过量的氨水:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O |
| D.向FeSO4溶液中加少量过氧化钠粉末:6H2O+4Na2O2+4Fe2+=4Fe(OH)3↓+O2↑+8Na+ |
下列离子方程式不正确的是
| A.碳酸氢钙溶液跟盐酸反应:Ca(HC03)2+2H+=Ca2++2H20+2C02↑ |
| B.碘化钾溶液跟适量溴水反应:2I一+Br2=I2+2Br— |
| C.将金属锂加入水中:2Li+2H20=2Li++20H一+H2↑ |
| D.将氯气通人氯化亚铁溶液中2Fe2++C12=2Fe3++2Cl一 |
能正确表示下列化学反应的离子方程式是
| A.饱和石灰水跟稀硝酸反应Ca(OH)2 + 2H+ = Ca2+ + 2H2O |
| B.钠和水反应Na+2H2O=Na++H2↑+2OH- |
| C.大理石与盐酸反应 CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.硫酸与氢氧化钡溶液反应 Ba2++OH-+H++SO42-= BaSO4↓+ H2O |
下列离子方程式书写正确的是( )。
| A.将SO2通入酸性KMnO4溶液:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+ |
| B.将Na2CO3溶液滴入等浓度等体积的盐酸中:CO32-+H+=HCO3- |
| C.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑ |
| D.硫化钠水溶液呈碱性的原因:S2-+2H2O=H2S+2OH- |
常温下,下列各组离子在指定的溶液中可能大量共存的是( )
| A.无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- |
| B.含大量Fe3+的溶液中:K+、I-、SO42-、NO3- |
| C.与Al反应放出H2的溶液中:NH4+、Na+、NO3-、F- |
| D.由水电离出的c(H+)=1.0×10-14 mol·L-1的溶液中:Mg2+、K+、Cl-、SO42- |
下列反应的离子方程式书写正确的是( )
| A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2—+4NH4++2H2O |
| B.浓烧碱溶液中加入铝片:Al+2OH-=AlO2—+H2↑ |
| C.用浓NaOH溶液溶解Al2O3:2OH-+Al2O3=2AlO2—+H2O |
| D.往碳酸镁中滴加稀盐酸:CO32—+2H+=CO2↑+H2O |
某无色溶液含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32—、⑥SO42—中的
若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 | 操作 | 现象 |
| (1) | 用pH试纸检验 | 溶液的pH大于7 |
| (2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向所得水溶液中加入Ba(NO3)2溶液和稀硝酸 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加入AgNO3溶液和稀硝酸 | 有白色沉淀产生 |
下列结论正确的是( )
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑥
C.不能确定的离子是①
D.不能确定的离子是③⑤
常温下,下列分子或离子在指定的分散系中能大量共存的一组是( )。
| A.使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- |
B.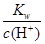 =0.1 mol·L-1的溶液:Na+、Cu2+、HCO3-、NO3- =0.1 mol·L-1的溶液:Na+、Cu2+、HCO3-、NO3- |
| C.空气:CH4、CO2、SO2、NO |
| D.0.1 mol·L-1 NaAlO2溶液:H+、Na+、Cl-、SO42- |