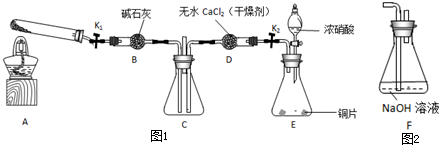
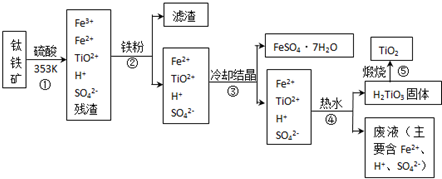
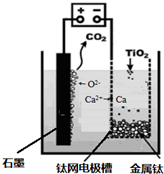
题目内容
(2012?海淀区一模)聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域具有广泛应用.下图是利用乙酰丙酸(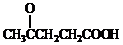 )合成聚芳酯E的路线:
)合成聚芳酯E的路线:
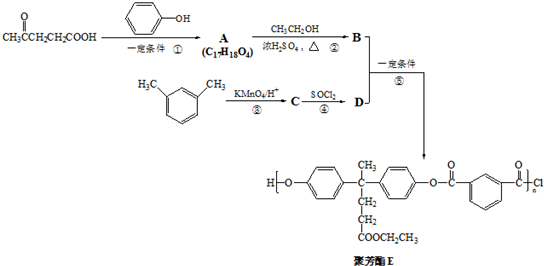
已知:①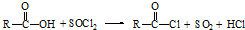
②
(R、R′表示烃基)
(1)乙酰丙酸中含有的官能团是羰基和
(2)下列关于有机物A的说法正确的是
a.能发生加聚反应 b.能与浓溴水反应
c.能发生消去反应 d.能与H2发生加成反应
(3)A→B的化学方程式为
 .
.
(4)D的结构简式为
 .
.
(5)C的分子式为
①能发生银镜反应②能与NaHCO3溶液反应③分子中有苯环,无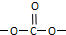 结构
结构
在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式: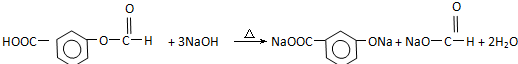
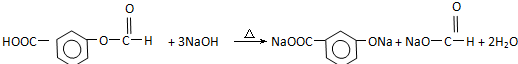 .
.
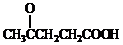 )合成聚芳酯E的路线:
)合成聚芳酯E的路线:
已知:①
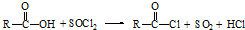
②

(R、R′表示烃基)
(1)乙酰丙酸中含有的官能团是羰基和
羧基
羧基
(填官能团名称).(2)下列关于有机物A的说法正确的是
bd
bd
(填字母序号).a.能发生加聚反应 b.能与浓溴水反应
c.能发生消去反应 d.能与H2发生加成反应
(3)A→B的化学方程式为


(4)D的结构简式为


(5)C的分子式为
C8H6O4
C8H6O4
,符合下列条件的C的同分异构体有13
13
种.①能发生银镜反应②能与NaHCO3溶液反应③分子中有苯环,无
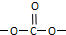 结构
结构在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式:
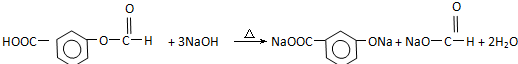
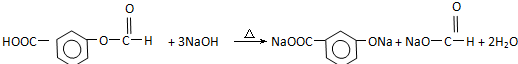
分析:由合成路线可知,反应①为加成反应,则A为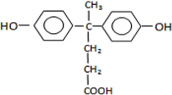 ,反应②为酯化反应,则B为
,反应②为酯化反应,则B为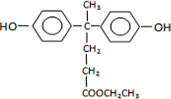 ,反应③为氧化反应,则C为
,反应③为氧化反应,则C为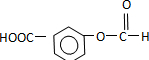 ,反应④为取代反应,则D为
,反应④为取代反应,则D为 ,反应⑤为缩聚反应,生成E,结合有机物的结构与性质来解答.
,反应⑤为缩聚反应,生成E,结合有机物的结构与性质来解答.
 ,反应②为酯化反应,则B为
,反应②为酯化反应,则B为 ,反应③为氧化反应,则C为
,反应③为氧化反应,则C为 ,反应④为取代反应,则D为
,反应④为取代反应,则D为 ,反应⑤为缩聚反应,生成E,结合有机物的结构与性质来解答.
,反应⑤为缩聚反应,生成E,结合有机物的结构与性质来解答.解答:解:由合成路线可知,反应①为加成反应,则A为 ,反应②为酯化反应,则B为
,反应②为酯化反应,则B为 ,反应③为氧化反应,则C为
,反应③为氧化反应,则C为 ,反应④为取代反应,则D为
,反应④为取代反应,则D为 ,反应⑤为缩聚反应,生成E,
,反应⑤为缩聚反应,生成E,
(1)由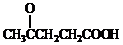 可知,乙酰丙酸中含有的官能团是羰基和羧基,故答案为:羧基;
可知,乙酰丙酸中含有的官能团是羰基和羧基,故答案为:羧基;
(2)A为 ,含酚-OH、-COOH、苯环,则能与溴水、氢气反应,而不能发生消去反应、加聚反应,故答案为:bd;
,含酚-OH、-COOH、苯环,则能与溴水、氢气反应,而不能发生消去反应、加聚反应,故答案为:bd;
(3)A→B的化学方程式为 ,
,
故答案为: ;
;
(4)由上述分析可知,D为 ,故答案为:
,故答案为: ;
;
(5)由上述分析可知,C为 ,分子式为C8H6O4,符合①能发生银镜反应②能与NaHCO3溶液反应③分子中有苯环,无
,分子式为C8H6O4,符合①能发生银镜反应②能与NaHCO3溶液反应③分子中有苯环,无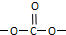 结构的同分异构体中含-CHO、-COOH、酚-OH及苯环,移动取代基的位置,有4+4+2=10种,若含HCOO-和-COOH,存在邻、间、对3种,共有10+3=13种,其中有机物分子中苯环上只有2个取代基,与足量NaOH溶液共热反应的化学方程式为
结构的同分异构体中含-CHO、-COOH、酚-OH及苯环,移动取代基的位置,有4+4+2=10种,若含HCOO-和-COOH,存在邻、间、对3种,共有10+3=13种,其中有机物分子中苯环上只有2个取代基,与足量NaOH溶液共热反应的化学方程式为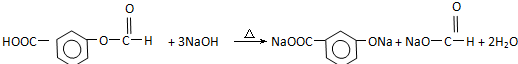 ,
,
故答案为:C8H6O4;13;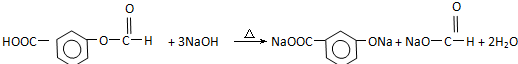 .
.
 ,反应②为酯化反应,则B为
,反应②为酯化反应,则B为 ,反应③为氧化反应,则C为
,反应③为氧化反应,则C为 ,反应④为取代反应,则D为
,反应④为取代反应,则D为 ,反应⑤为缩聚反应,生成E,
,反应⑤为缩聚反应,生成E,(1)由
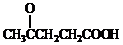 可知,乙酰丙酸中含有的官能团是羰基和羧基,故答案为:羧基;
可知,乙酰丙酸中含有的官能团是羰基和羧基,故答案为:羧基;(2)A为
 ,含酚-OH、-COOH、苯环,则能与溴水、氢气反应,而不能发生消去反应、加聚反应,故答案为:bd;
,含酚-OH、-COOH、苯环,则能与溴水、氢气反应,而不能发生消去反应、加聚反应,故答案为:bd;(3)A→B的化学方程式为
 ,
,故答案为:
 ;
;(4)由上述分析可知,D为
 ,故答案为:
,故答案为: ;
;(5)由上述分析可知,C为
 ,分子式为C8H6O4,符合①能发生银镜反应②能与NaHCO3溶液反应③分子中有苯环,无
,分子式为C8H6O4,符合①能发生银镜反应②能与NaHCO3溶液反应③分子中有苯环,无 结构的同分异构体中含-CHO、-COOH、酚-OH及苯环,移动取代基的位置,有4+4+2=10种,若含HCOO-和-COOH,存在邻、间、对3种,共有10+3=13种,其中有机物分子中苯环上只有2个取代基,与足量NaOH溶液共热反应的化学方程式为
结构的同分异构体中含-CHO、-COOH、酚-OH及苯环,移动取代基的位置,有4+4+2=10种,若含HCOO-和-COOH,存在邻、间、对3种,共有10+3=13种,其中有机物分子中苯环上只有2个取代基,与足量NaOH溶液共热反应的化学方程式为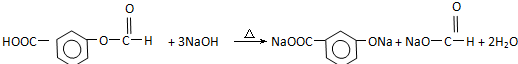 ,
,故答案为:C8H6O4;13;
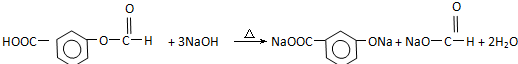 .
.点评:本题考查有机物的合成,明确合成路线中发生的化学反应来推断各物质是解答的关键,注意反应条件与反应类型的关系、碳链骨架的变化,利用结构与性质的关系来解答,题目难度中等,(5)中同分异构体的推断为解答的难点.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
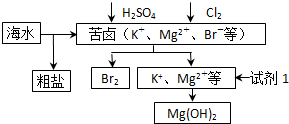 (2012?海淀区一模)海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法不正确的是( )
(2012?海淀区一模)海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法不正确的是( )