题目内容
8.已知某浓盐酸与二氧化锰在加热下可以发生下列反应:MnO2+4HCl(浓)$\frac{\underline{\;△\;}}{\;}$MnCl2+Cl2↑+2H2O
①请尝试用单线桥法来表示该反应.
②写出该反应的离子反应方程式.
③当有43.5gMnO2参与反应时,作还原剂的盐酸的物质的量是1mol.
分析 ①转移电子数目为2,电子由化合价升高的转移给化合价降低的元素;
②氧化物形成化学式形式,氯化锰、HCl改写成离子形式;
③作还原剂的HCl反应生成Cl2,根据电子转移守恒计算作还原剂的HCl的物质的量.
解答 解:①转移电子数目为2,用单线桥法来表示电子转移数目与方向为: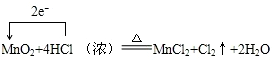 ,
,
答:用单线桥法来表示该反应为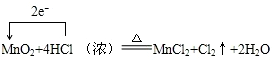 .
.
②氧化物形成化学式形式,氯化锰、HCl改写成离子形式,反应离子方程式为:MnO2+4H+(浓)$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O,
答:反应离子方程式为:MnO2+4H+(浓)$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O.
③43.5gMnO2的物质的量为$\frac{43.5g}{87g/mol}$=0.5mol,作还原剂的HCl反应生成Cl2,根据电子转移守恒,作还原剂的HCl的物质的量为$\frac{0.5mol×(4-2)}{1}$=1mol,
故答案为:1mol.
点评 本题考查氧化还原反应、离子方程式书写等,比较基础,注意单线桥、双线桥表示电子转移数数目与方向.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
18.2015年8月12日晚,天津塘沽滨海新区危险品仓库发生大爆炸,造成了巨大损失.据悉,该危险品仓库存放的危险品有多种,包括剧毒化学品氰化钠(NaCN).下列有关氰化钠的说法中错误的是( )
| A. | NaCN中碳元素的化合价为+4 | |
| B. | NaCN易溶于水,其水溶液呈碱性 | |
| C. | 可用强氧化剂如H2O2等将NaCN氧化为无毒物质 | |
| D. | 为防止中毒,须加强对地表水、排海口等的氰化物排查 |
19.下列实验中,依据实验操作及现象,得出的结论正确的是( )
| 操 作 | 现 象 | 结 论 | |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO42- |
| C | 向溶液X中加入稀盐酸,并将产生的无色无味气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有 CO32-或HCO3- |
| D | 无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| A. | A | B. | B | C. | C | D. | D |
16.常压下、120℃时,1体积某气态烃A和8体积足量的氧气混合点燃,充分燃烧后恢复到原来状况,混合气体的体积仍为9体积,则下列说法正确的是( )
| A. | 若A为单一气体,则不是甲烷就是乙烯 | |
| B. | 若A为单一气体,则可能是丙烷 | |
| C. | 若A为混合气体,则可能是甲烷,丙烯,乙炔按体积比2:1:1混合而成 | |
| D. | 若A为混合气体,则可能是乙烯,乙烷按质量比14:22混合而成室温时 |
3.下列说法或表示方法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石,s)=C(石墨,s)△H=-1.90 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 氢气的燃烧热285.8kJ/mol,氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(l)△H=+285.8 kJ/mol | |
| D. | 氢氧化钡晶体与氯化铵晶体混合吸热,反应物的总键能之和高于生成物的总键能之和 |
13.下列实验操作不正确的是( )
| A. | 用量筒量取25.0mL蒸馏水 | B. | 用分液漏斗分离乙醇和水 | ||
| C. | 用烧杯溶解FeCl3固体试样 | D. | 用托盘天平称量NaCl固体5.8g |
20.下列说法错误的是( )
| A. | 容量瓶使用前必须检漏 | |
| B. | 胶体分散质颗粒直径在1cm~100cm之间 | |
| C. | 通过过滤操作可以把沉淀与溶液分开 | |
| D. | 在用pH试纸测量某溶液的pH时,不能先湿润pH试纸 |
17.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中: c(Na+)>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH${\;}_{4}^{+}$)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
18.下列各组物质反应时,只能发生一个反应的是( )
| A. | 铁与硫 | B. | 碳与氧气 | ||
| C. | 二氧化硫和氢氧化钠溶液 | D. | 氯化铝溶液和氢氧化钠溶液 |