题目内容
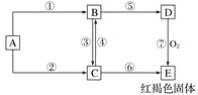
【题目】砷在工业、农业、医学等领域用途非常广泛。回答下列问题:
⑴确定砷华(成分为 As2O3)是晶体还是非晶体,可通过______________加以确定。
⑵基态砷原子的价电子排布式为 ______________。
⑶ AsH3 空间构型为___________,NH3 沸点比 AsH3 高,其原因为__________________;药物胂凡纳明(![]() )分子中,共价键的类型有________ , 原子采用 sp2 杂化的有_____。
)分子中,共价键的类型有________ , 原子采用 sp2 杂化的有_____。
⑷砷酸(H3AsO4)的酸性比亚砷酸(H3AsO3)_______(填“强”或“弱”),其理由是 ______________。
⑸最近我国科学家研制的一种“稀磁材料”,其晶胞结构如下图所示。与 Zn 原子紧邻的 Zn 数目为_________个, 该晶体的密度为 _____________ g·cm-3(不必计算结果,写出表达式即可)。

【答案】X-射线衍射 4s24p3 三角锥形 氨分子间能形成氢键,分子间作用力增大 σ键和π键 C、As 强 前者有一个非羟基氧,后者不含非羟基氧 12 ![]()
【解析】
(1)可用X-射线衍射的方法来确定某种物质是晶体还是非晶体,故答案为:X-射线衍射;
(2)As为33号元素,其基态原子的核外电子排布式为[Ar]3d104s24p3,则价电子排布式为4s24p3,故答案为:4s24p3;
(3)AsH3的价电子对数为![]() ,含有1个孤电子对,则其空间构型为三角锥形,由于NH3分子间形成氢键,分子间作用力增大,因此NH3的沸点高于AsH3,胂凡纳明(
,含有1个孤电子对,则其空间构型为三角锥形,由于NH3分子间形成氢键,分子间作用力增大,因此NH3的沸点高于AsH3,胂凡纳明(![]() )分子中,含有的共价键类型有σ键和π键,其中苯环中的C和分子中的As均采用sp2杂化方式,故答案为:三角锥形;氨气分子间形成氢键,分子间作用力增大;σ键和π键;C、As;
)分子中,含有的共价键类型有σ键和π键,其中苯环中的C和分子中的As均采用sp2杂化方式,故答案为:三角锥形;氨气分子间形成氢键,分子间作用力增大;σ键和π键;C、As;
(4)因为砷酸有一个非羟基氧,而亚砷酸不含非羟基氧,所以亚砷酸的酸性比砷酸弱,故答案为:强;前者有一个非羟基氧,后者不含非羟基氧;
(5)根据晶胞结构分析可知,Zn原子位于晶胞的顶点和面心,一个晶胞中Zn原子的个数为![]() ,与Zn原子紧邻的Zn数目为12个,Li原子位于晶胞的棱心和体心,则一个晶胞中Li原子的个数为
,与Zn原子紧邻的Zn数目为12个,Li原子位于晶胞的棱心和体心,则一个晶胞中Li原子的个数为![]() ,As原子位于晶胞体内,一个晶胞含有4个As原子,则一个晶胞的质量为
,As原子位于晶胞体内,一个晶胞含有4个As原子,则一个晶胞的质量为![]() ,晶胞的体积为(5.94×10-8)3cm3,根据公式
,晶胞的体积为(5.94×10-8)3cm3,根据公式![]() 可得该晶体的密度
可得该晶体的密度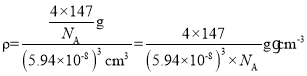 ,故答案为:12;
,故答案为:12;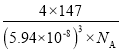 。
。