题目内容
【题目】按要求回答下列有关问题。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)=N2(g)+2CO2(g);△H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO达到平衡状态。若要同时提高该反应的速率和NO的转化率,采取的措施有 、 。(写出2个)
(2)对反应N2O4(g)![]() 2NO2(g) △H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是__________。
2NO2(g) △H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是__________。
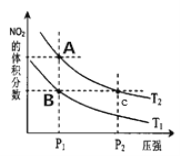
a.A、C两点的反应速率:A>C
b.A、C两点气体的颜色:A浅,C深
c.由状态A到状态B,可以用加热的方法
d.A、C两点的化学平衡常数:A>C
(3)某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量)。则该反应的化学平衡常数:K=____________。
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量)。则该反应的化学平衡常数:K=____________。
【答案】
(1)增大压强、向容器中再充入CO气体。
(2)b;(3)0.16
【解析】
试题分析:(1)若要同时提高该反应的速率和NO的转化率,外界条件增强,平衡正向移动,措施是增大压强或向容器中充入CO气体,故答案为:增大压强或向容器中充入CO气体;
(2)A.C点的压强大于A点的压强,压强越大,化学反应速率越快,所以反应速率C>A,故A错误;B.A、C两点温度相等,C点的压强大于A点的压强,体积减小增大压强,二氧化氮浓度会变大,所以A浅,C深,故B正确;C.从A到B,二氧化氮的体积分数减小,平衡逆向移动,所以气体物质的量减小,气体的平均相对分子质量M=![]() ,质量是守恒的,所以n减小,M会增大,即A<B,故C错误;D. A、C两点的温度相同,化学平衡常数相同,故D错误;故选b;
,质量是守恒的,所以n减小,M会增大,即A<B,故C错误;D. A、C两点的温度相同,化学平衡常数相同,故D错误;故选b;
(3)恒容容器中,气体的压强之比等于气体的物质的量之比,从反应物和生成物的化学计量数和反应前后压强之比可知,C和D中至少有一种物质不是气体,反应方程式为:
3A(g)+2B(g)![]() 4C(?)+2D(?)
4C(?)+2D(?)
反应前(mol) 4 2 0 0
反应了(mol) 1.2 0.8 1.6 0.8
平衡后(mol) 2.8 1.2 1.6 0.8
由气体物质的量之比等于压强之比可得反应后气体物质的量为![]() ×(4+2)=4.8mol,所以D为气体、C不是气体,则化学平衡常数K=
×(4+2)=4.8mol,所以D为气体、C不是气体,则化学平衡常数K= =
=![]() =0.16,故答案为:0.16。
=0.16,故答案为:0.16。

 名校课堂系列答案
名校课堂系列答案