题目内容

请结合下表数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
(2)在溶液B中加入CuO的作用是
(3)操作a的目的是
(4)在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用多量盐酸和低温蒸干的目的是
(2)加入氧化铜,调节溶液的PH,除去铁离子杂质;
(3)a为洗涤操作,除去氢氧化铜表面的可溶性杂质;
(4)根据平衡Cu2++2H2O?Cu(OH)2+2H+进行分析.
故答案为:氧化Fe2+生成Fe3+ 有利于沉淀分离;2H++ClO-+2 Fe2+=2 Fe3++Cl-+H2O;
(2)在溶液B中加CuO调节溶液的pH使Fe3+完全沉淀,根据表中数据,Fe3+完全沉淀时PH的范围是3~4,
故答案为:调节溶液的PH为3~4,使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+;
(3)操作a为洗涤,目的是洗涤氢氧化铜表面的可溶性杂质,
故答案为:洗涤氢氧化铜表面的可溶性杂质;
(4)因为溶液中存在以下平衡:Cu2++2H2O?Cu(OH)2+2H+,加入过量盐酸和低温,能使平衡逆移,防止Cu2+水解,
故答案为:抑制 Cu2+水解.

(10分)工业上制取CuCl2的生产流程如下: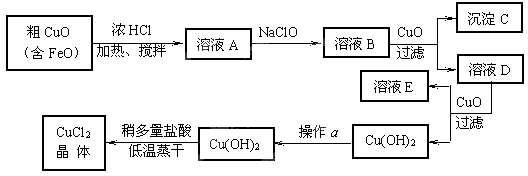
请结合下表数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
此反应离子方程式为 ;
⑵ 在溶液B中加入CuO的作用是 ;
⑶ 操作a的目的是 ;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。
(10分)工业上制取CuCl2的生产流程如下:
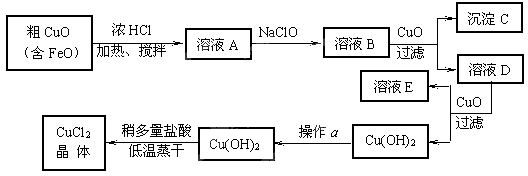
请结合下表数据,回答下列问题:
|
物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
⑴ 溶液A中加入NaClO的目的是 ;
此反应离子方程式为 ;
⑵ 在溶液B中加入CuO的作用是 ;
⑶ 操作a的目的是 ;[来源:]
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。
(8分,每空2分)工业上制取CuCl2的生产流程如下:
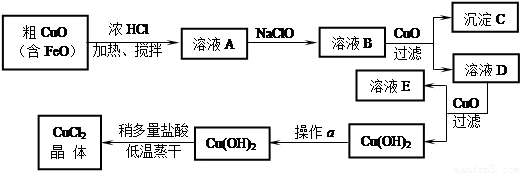
请结合下表数据,回答下列问题:
|
物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
溶度积/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
|
完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
⑴ 溶液A中加入NaClO的目的是 ;
⑵ 在溶液B中加入CuO的作用是 ;
⑶ 操作a的目的是 ;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。
