题目内容
碘与氢气一定条件下反应的热化学方程式如下
(Ⅰ) I2(g) + H2(g)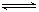 2HI(g)
2HI(g) 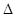 H= —9.48 KJ/mol
H= —9.48 KJ/mol
(Ⅱ) I2(s) + H2(g)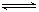 2HI(g)
2HI(g) 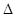 H=" 26.48" KJ/mol
H=" 26.48" KJ/mol
下列判断正确的是
A.2 g H2(g)通入254 g I2(g) 中在该条件下反应的反应放热为9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D.物质的量相同时,反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高
【答案】
D
【解析】
试题分析:该反应是可逆反应,反应物的转化率达不到100%,所以A中反应放热小于9.48 kJ,A不正确;
考点:根据盖斯定律可知,(Ⅱ)-(Ⅰ)即得到I2(s) (Ⅰ),则△H=26.48 KJ/mol+9.48 KJ/mol=35.96 KJ/mol,即1 mol固态碘与1 mol气态碘所含的能量相差35.96 kJ,B不正确;反应(Ⅰ)的产物和反应(Ⅱ)的产物相同,稳定性相同,C不正确,所以正确的答案选D。
(Ⅰ),则△H=26.48 KJ/mol+9.48 KJ/mol=35.96 KJ/mol,即1 mol固态碘与1 mol气态碘所含的能量相差35.96 kJ,B不正确;反应(Ⅰ)的产物和反应(Ⅱ)的产物相同,稳定性相同,C不正确,所以正确的答案选D。
考点:考查反应热的有关判断、计算以及应用
点评:该题是基础性试题额考查,试题难易适中,注重基础,侧重能力的培养,有利于培养学生的逻辑推理能力和创新思维能力,该题的关键是利用好盖斯定律。

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目