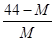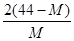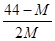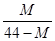题目内容
在一定条件下,将1mol/L CO和2mol/L 水蒸气混合后发生如下变化:CO(g)+H2O(g) 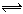 CO2(g)+H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为
CO2(g)+H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为
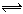 CO2(g)+H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为
CO2(g)+H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为| A.0.25 | B.0.17 | C.0.44 | D.1.0 |
B
根据三行式进行计算,
CO(g)+H2O(g)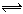 CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 1 2 0 0
转化浓度(mol/L) 1*40% 0.4 0.4 0.4
平衡浓度(mol/L) 0.6 1.6 0.4 0.4
平衡常数K=(0.4*0.4)/(0.6*1.6)=1/6=0.17,故选B
CO(g)+H2O(g)
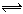 CO2(g)+H2(g)
CO2(g)+H2(g)起始浓度(mol/L) 1 2 0 0
转化浓度(mol/L) 1*40% 0.4 0.4 0.4
平衡浓度(mol/L) 0.6 1.6 0.4 0.4
平衡常数K=(0.4*0.4)/(0.6*1.6)=1/6=0.17,故选B

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
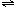 2C(气)达到平衡的标志是
2C(气)达到平衡的标志是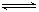 PCl3(g)+Cl2(g),反应达到平衡时,PCl3在混合气体中的体积分数为m%,保持温度和容积不变,再加入1mol PCl5,反应达到平衡时,PCl3在混合气体中的体积分数为n%,则m和n的关系正确的是( )
PCl3(g)+Cl2(g),反应达到平衡时,PCl3在混合气体中的体积分数为m%,保持温度和容积不变,再加入1mol PCl5,反应达到平衡时,PCl3在混合气体中的体积分数为n%,则m和n的关系正确的是( ) xC(g) + 2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol·Lˉ1,下列叙述中不正确的是 ( )
xC(g) + 2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol·Lˉ1,下列叙述中不正确的是 ( )
 2A(g)+B(g) 2C(g) △H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol·L-1,下列说法中正确的是 ( )
2A(g)+B(g) 2C(g) △H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol·L-1,下列说法中正确的是 ( )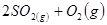

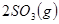 ,△H
,△H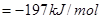 ,在相同温度下,向固定体积的密闭容器中通入
,在相同温度下,向固定体积的密闭容器中通入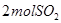 和
和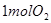 ,达到平衡时放出热量
,达到平衡时放出热量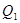 ;向另一个同体积的密闭容器中通入
;向另一个同体积的密闭容器中通入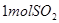 和
和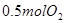 ,达到平衡时放出热量为
,达到平衡时放出热量为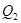 ,则下列关系中正确的是
,则下列关系中正确的是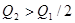
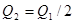
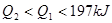

 2 SO3反应。进行到4mi n时,测得SO2为0.4mol,若反应进行到2min时,容器中的SO2为( )
2 SO3反应。进行到4mi n时,测得SO2为0.4mol,若反应进行到2min时,容器中的SO2为( ) 2CO+O2(反应从CO2开始)平衡体系的平均相对分子质量为M,在此条件下,CO2的分解率为
2CO+O2(反应从CO2开始)平衡体系的平均相对分子质量为M,在此条件下,CO2的分解率为